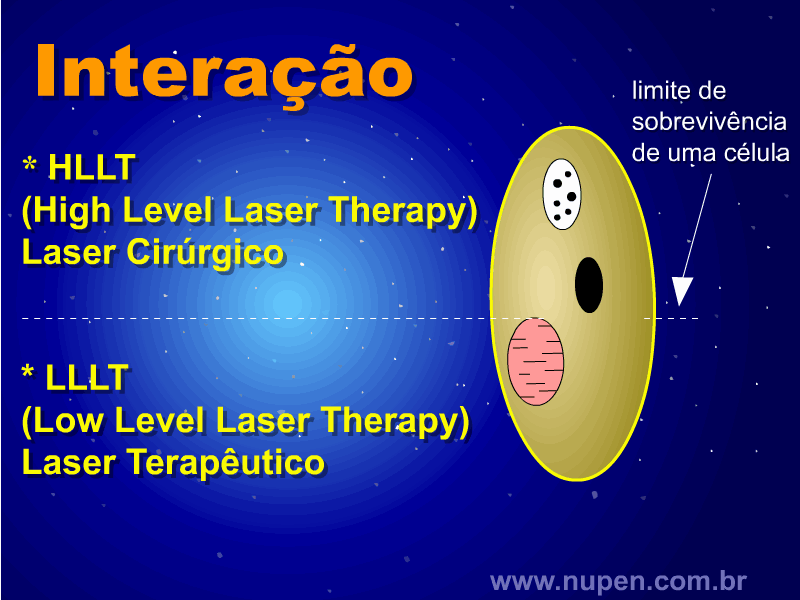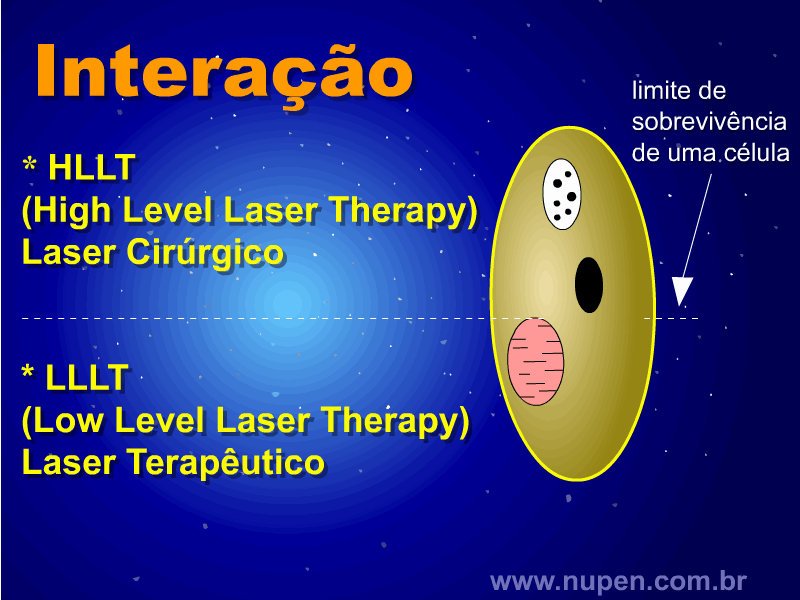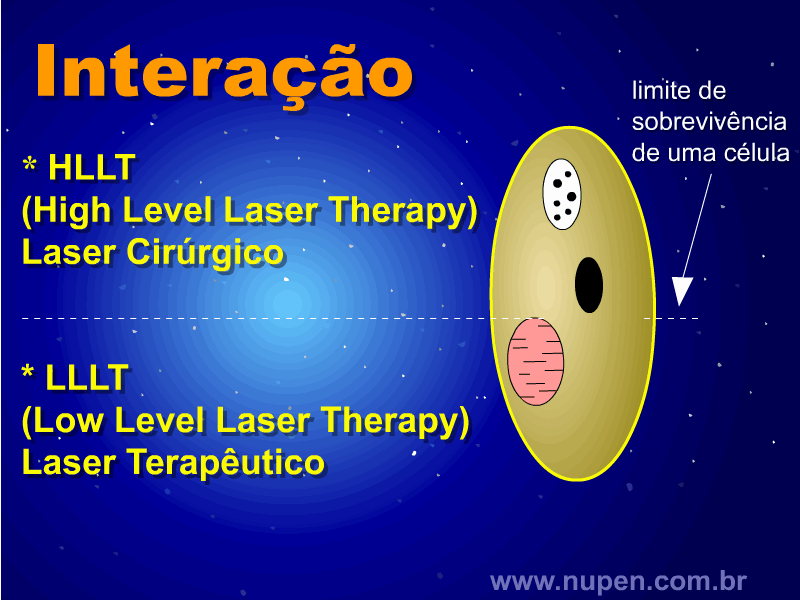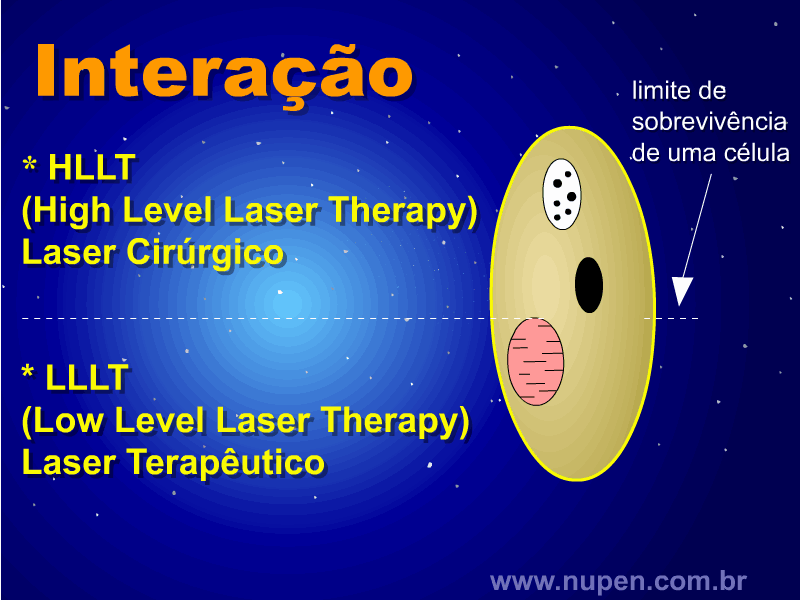
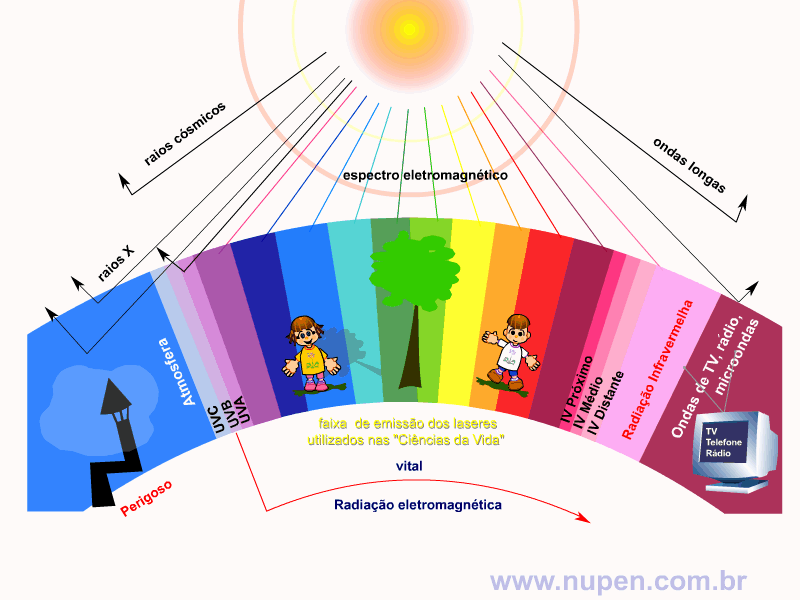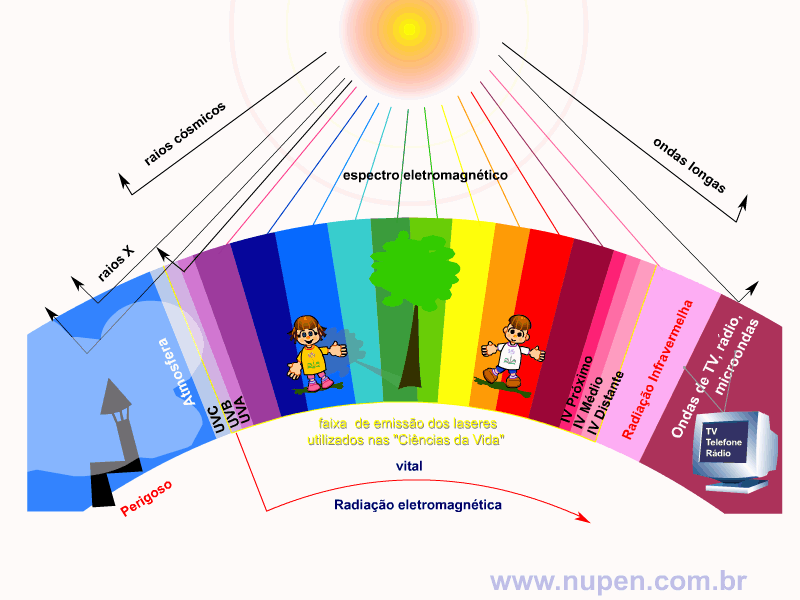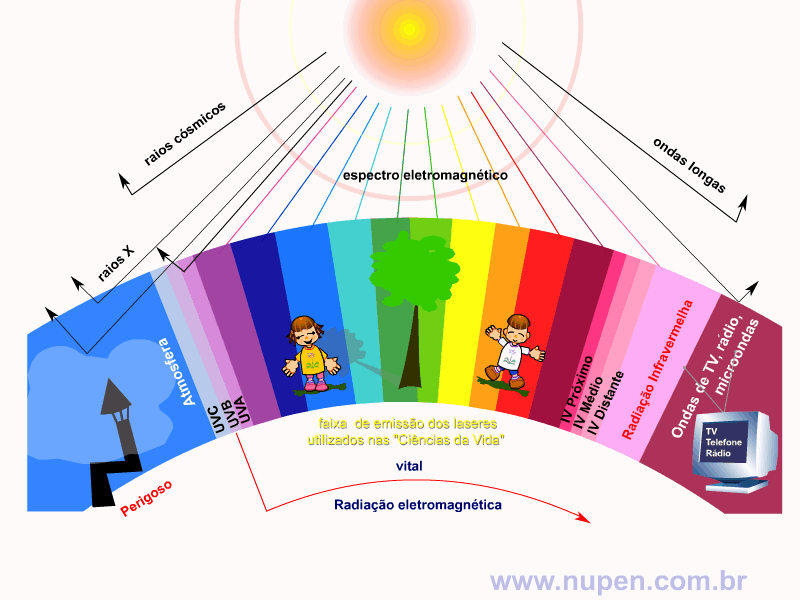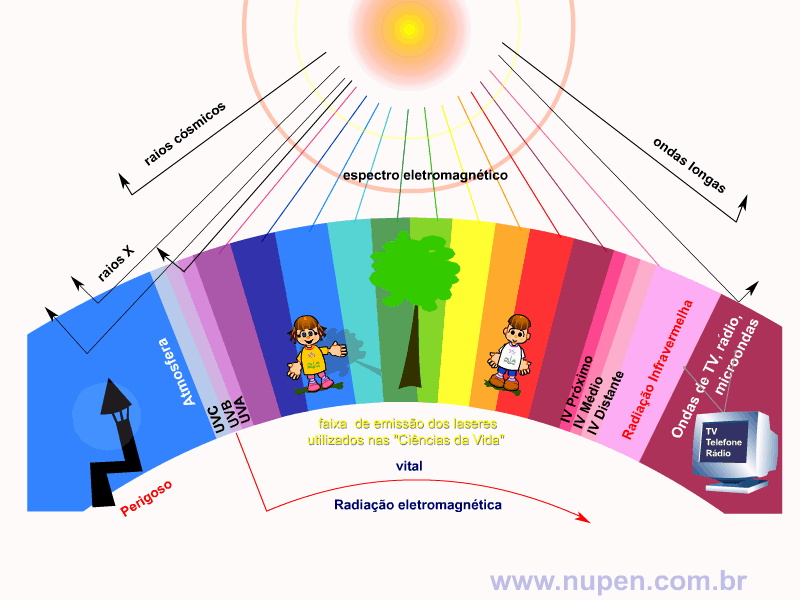
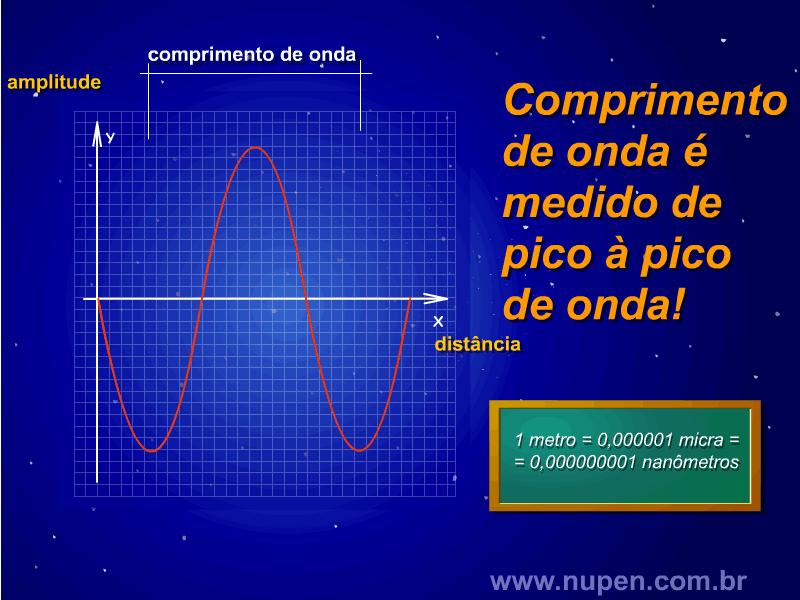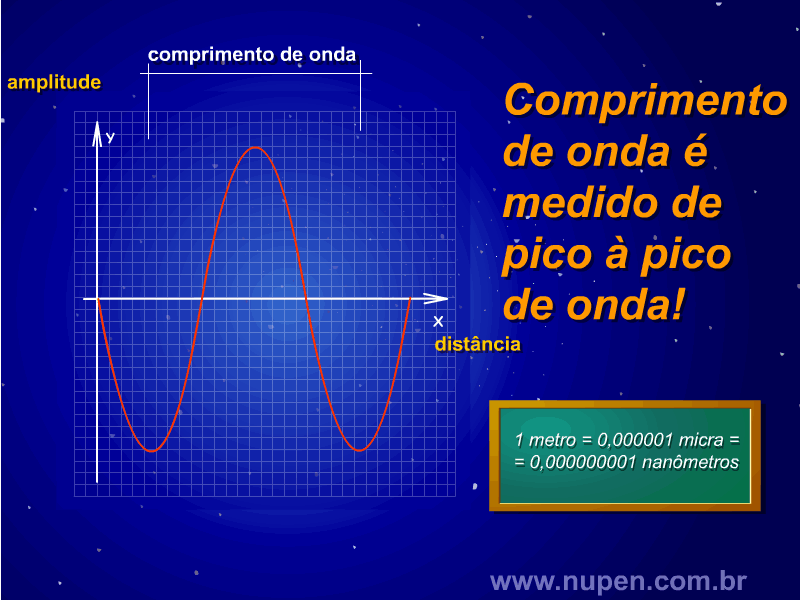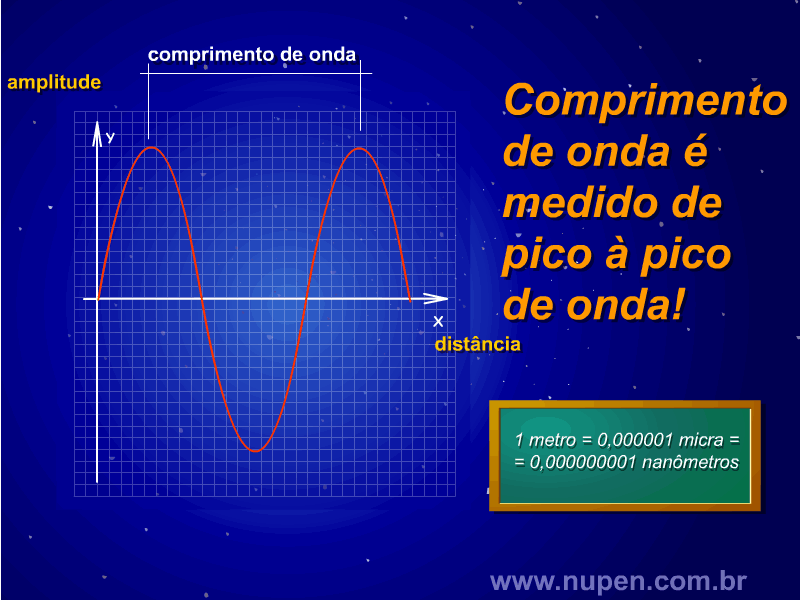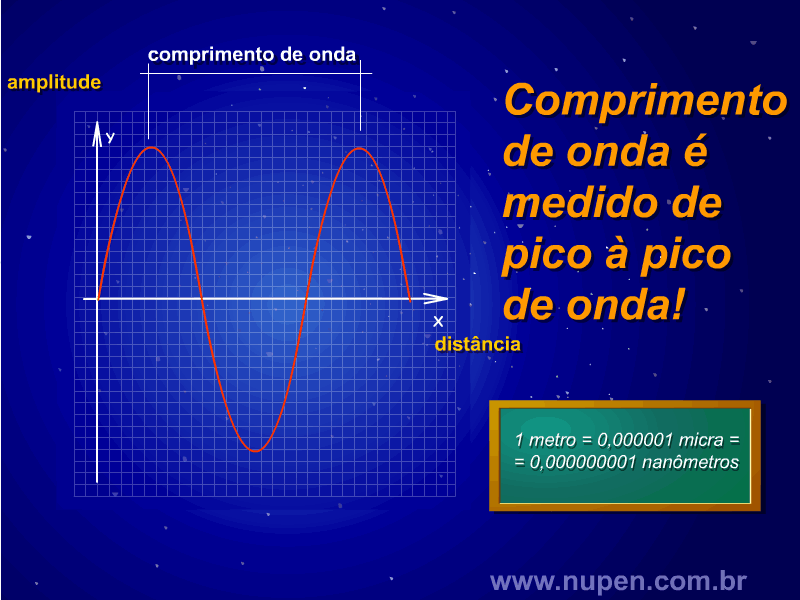
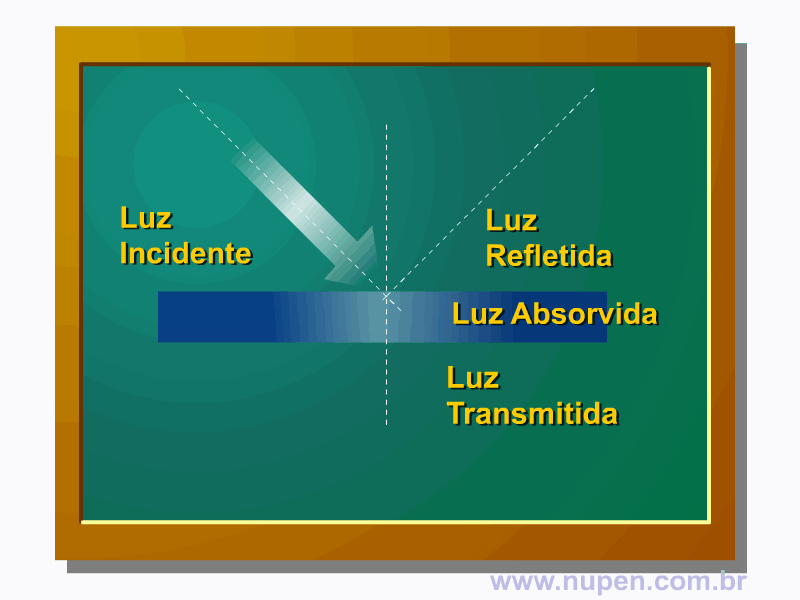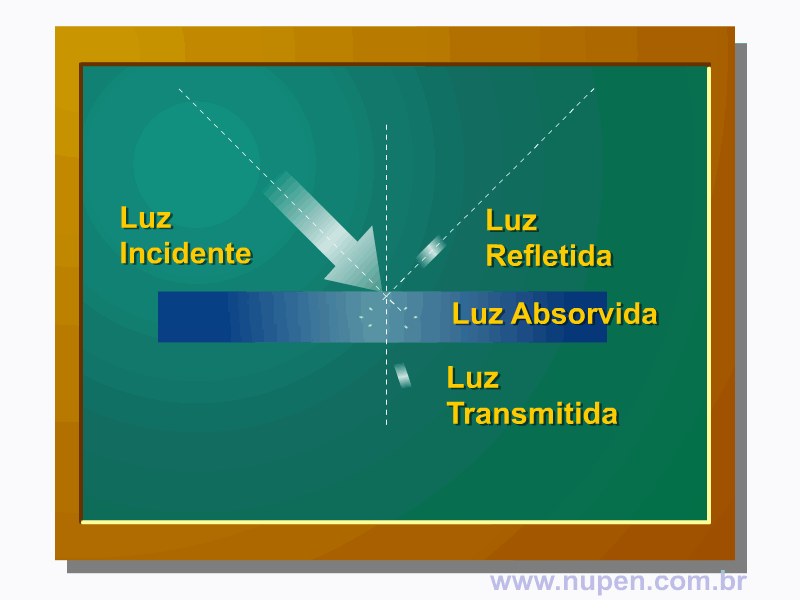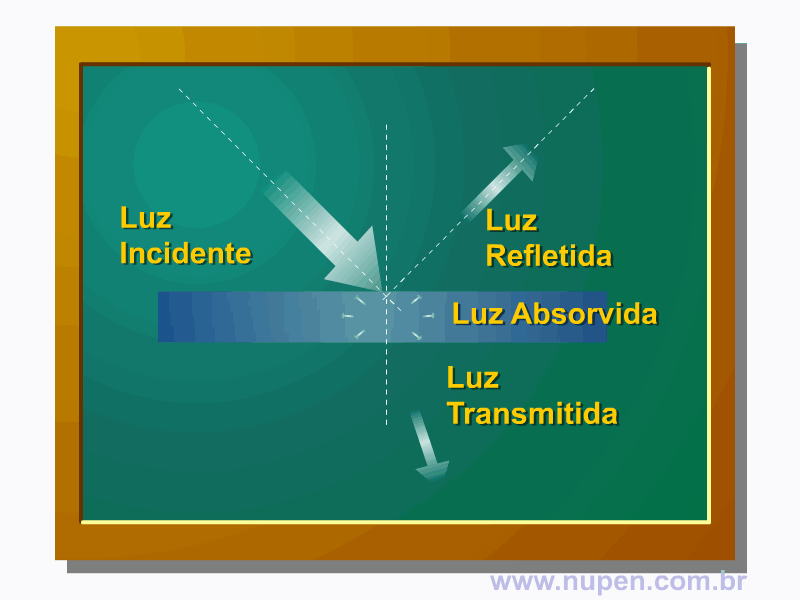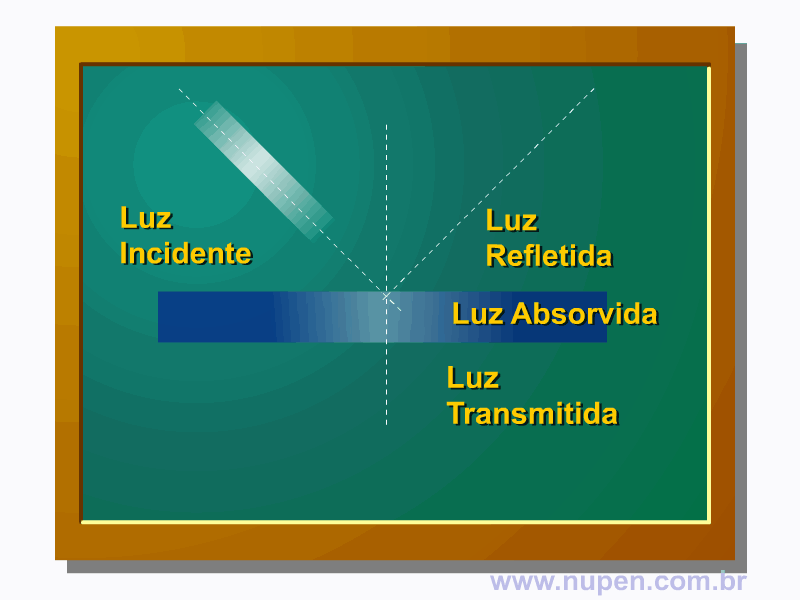
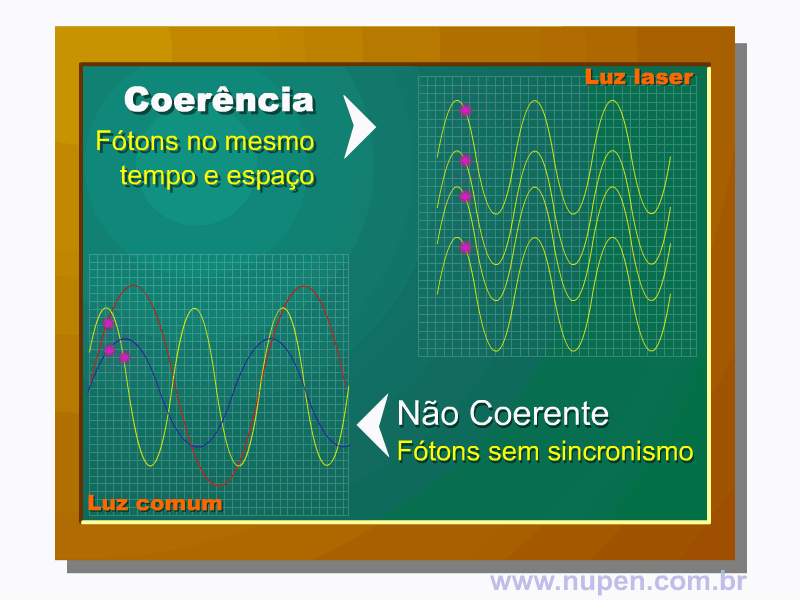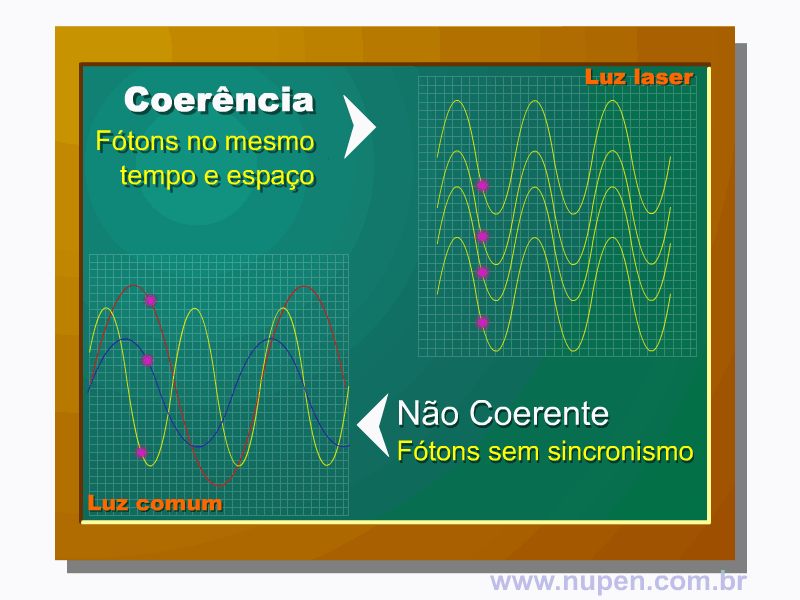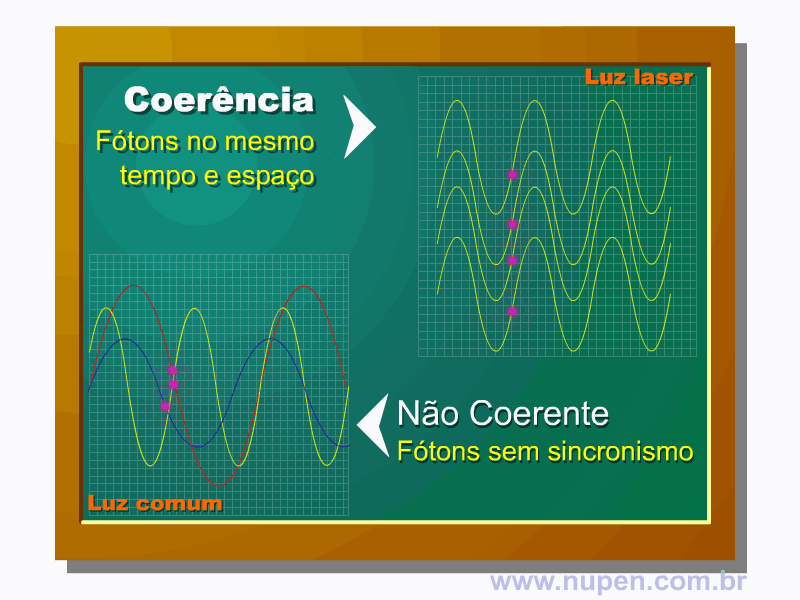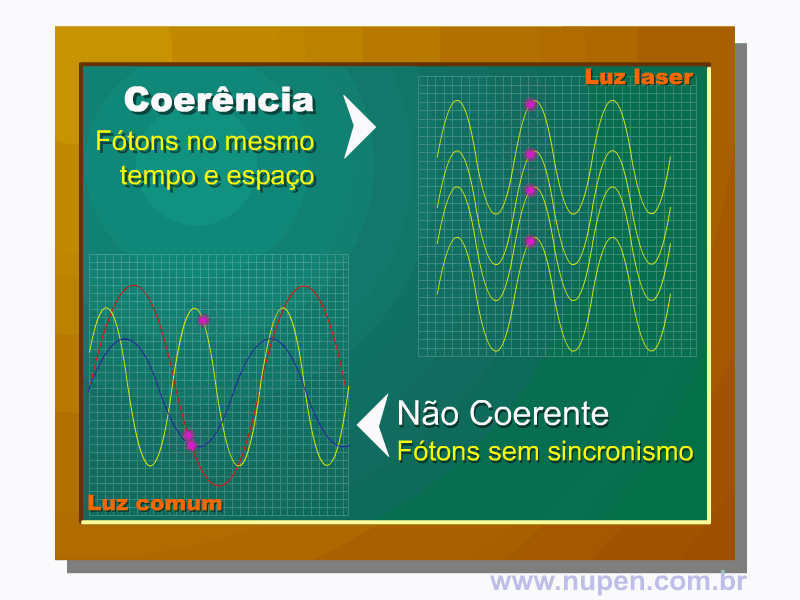
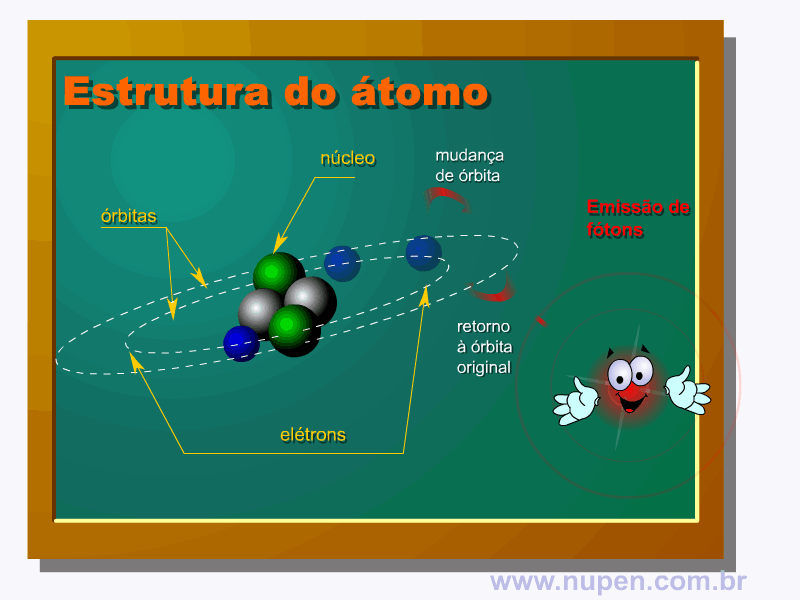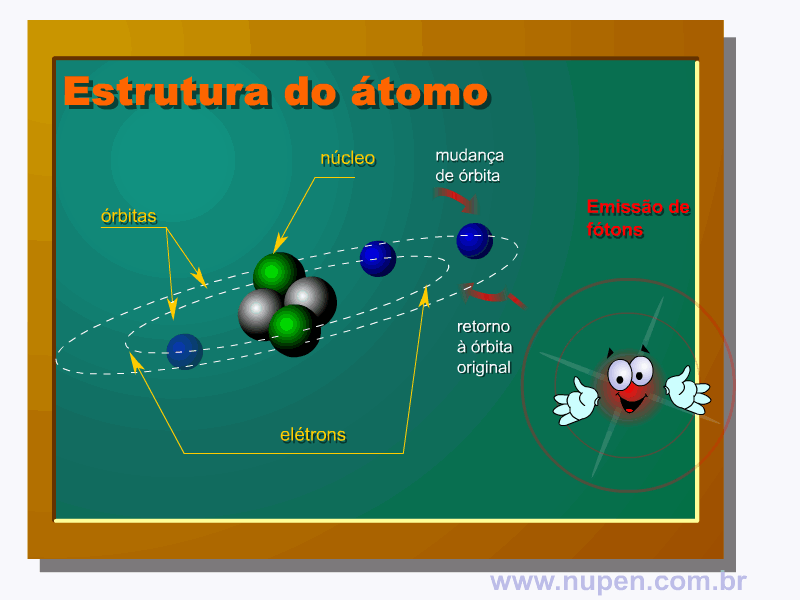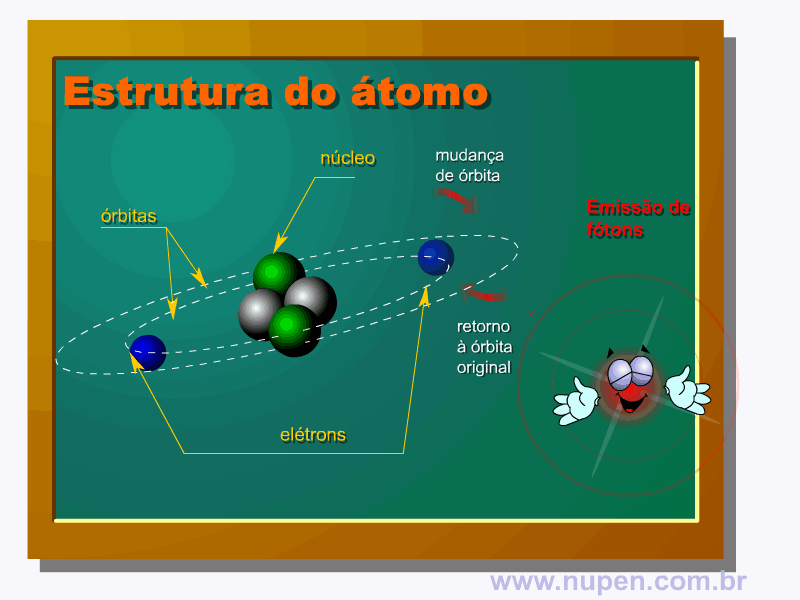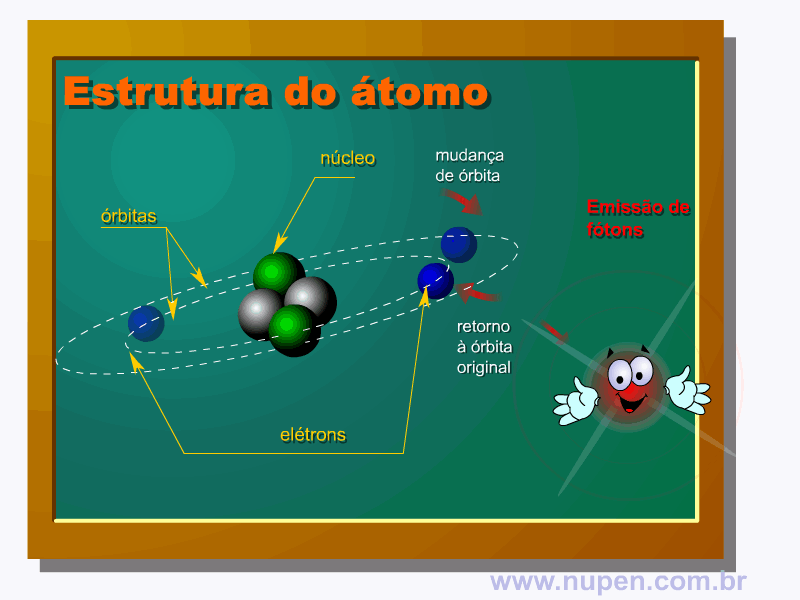
ALMEIDA-LOPES, L. Análise in vitro da Proliferação Celular de Fibroblastos de Gengiva Humana Tratados com Laser de Baixa Intensidade Utilizando Diferentes Parâmetros de Irradiação. Tese (Doutorado em Engenharia de Materiais), Interunidades IFSC/IQSC/EESC da Universidade de São Paulo, São Carlos, 2003b.
ALMEIDA-LOPES, L. Aplicações clínicas do laser não-cirúrgico. In: BRUGNERA, A.Jr.; PINHEIRO, A. L. B. Laseres na Odontologia Moderna. São Paulo: Pancast, p.99-120, 1998a.
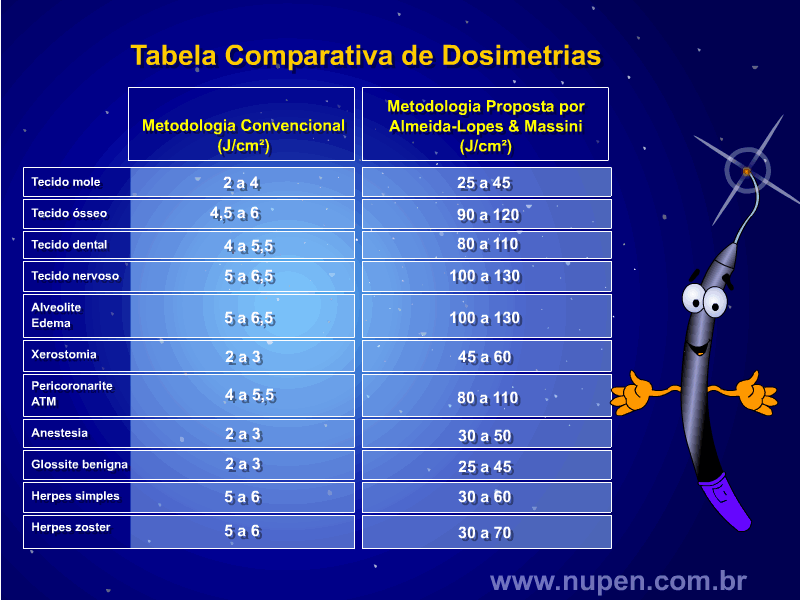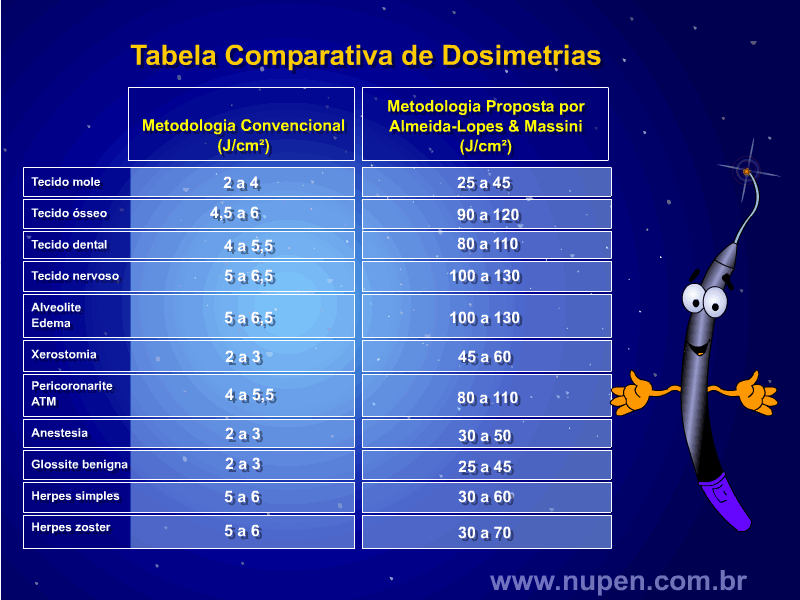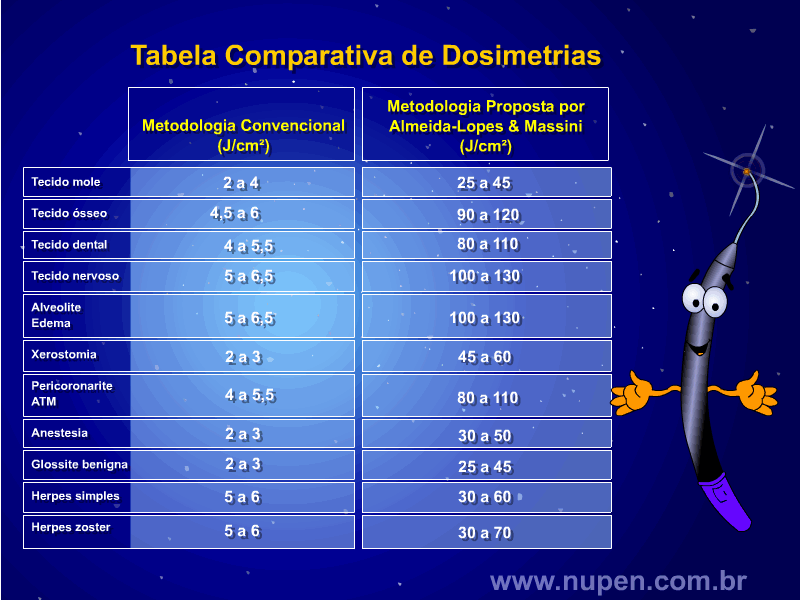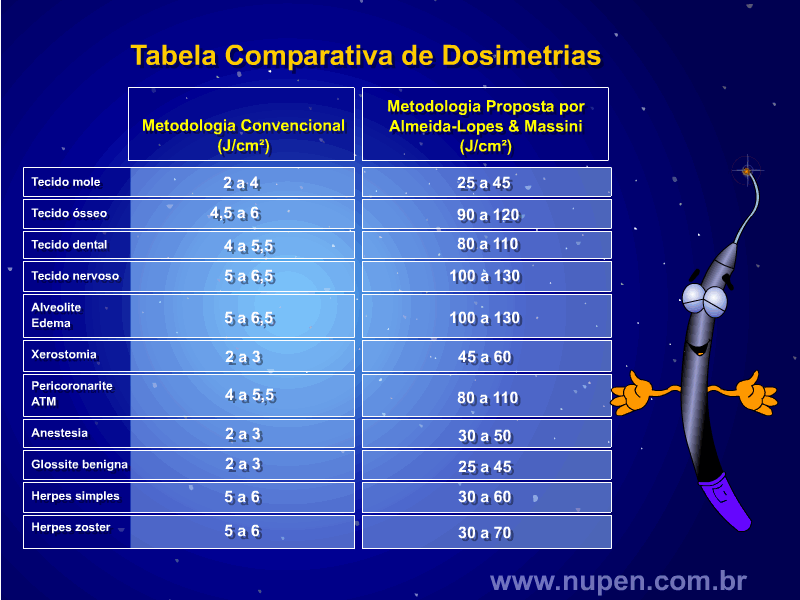
ALMEIDA-LOPES L. – Técnica da Drenagem Linfática Ativada por Laserterapia. In: Atualização Clínica em Odontologia, v.1; cap. 14; p. 327/340, Editora Artes Médicas, São Paulo, 2006. www.nupen.com.br – Odontologia – Biblioteca Virtual – Edema.
ALMEIDA-LOPES, L.; BAGNATO, V. S. Anais do VI SICEM, pág. 57/58, São Carlos, 30 a 31 de outubro de 2003a.
ALMEIDA-LOPES, L.; BRUGNERA, A. J. Soft-Laser no Tratamento das Algias Dentais. Anais do 120 Congresso Internacional de Odontologia do Rio de Janeiro da ABO, julho de 1994.
ALMEIDA-LOPES, L; FIGUEIREDO, A. C. R; LOPES, A. O uso do Laser Terapêutico no tratamento da inflamação na clínica odontológica, através da Drenagem Linfática. Revista_port da APCD, vol.56 , supl., junho, 2002c.
ALMEIDA-LOPES, L; MASSINI, R. J. Laserterapia, Conceitos e Aplicações. CD-ROM. DMC, São Carlos, Brasil, 2002a.
ALMEIDA-LOPES, L.; RIGAU J.; JAEGER M. M. M.; BRUGNERA, A. JR.; VÉLEZ-GONZÁLEZ, M. Acción del láser a baja densidad de potencia en la proliferación in vitro de fibroblastos de encía humana. Bol SELMQ, v. 14, n.5, p.14-18, Dic, 1998b.
ALMEIDA-LOPES, L.; RIGAU J.; ZÂNGARO, R.A.; GUIDUGLI-NETO, J.; JAEGER M. M. M. Comparison of the Low Level Laser Therapy on Cultured Human Gingival Fibroblasts Proliferation Using Different Irradiance and Same Fluence. Lasers Surg Med, 29:179-184, 2001.
AL-WATBAN, F. A. H.; ANDRÉS, B.L. The effect of He-Ne Laser (632.8 nm) and Solcoseryl In vitro. Lasers Med Sci, v.16, p.267-275, 2001.
AL-WATBAN, F. A. H.; ZHANG, Z. Dosimetry-related wound healing response in the rat model following helium neon laser LLLT. Laser Therapy, p.119-124, 1994.
AMORIM JC, de SOUSA GR, de BARROS SILVEIRA L, PRATES RA, PINOTTI M, RIBEIRO MS. Clinical study of the gingiva healing after gingivectomy and low-level laser therapy. Photomed Laser Surg. 2006 Oct;24(5):588-94.
AOKI A, SASAKI KM, WATANABE H, ISHIKAWA I. – Lasers in nonsurgical periodontal therapy. Periodontol 2000. 2004;36:59-97.
ASAGAI, Y.; UENO, T.; OHSHIRO, T. Application of low reactive-level laser therapy (LLLT) in the Functional Training of Cerebral Palsy Patients. In: 2nd CONGRESS WORLD ASSOCIATION FOR LASER THERAPY. Proceedings, Kansas City, USA, Sep 2-5. p.13, 1998.
ATAKA, I. Studies of Nd:YAG low power laser irradiation on stellate ganglion. In: Lasers in dentistry. Amsterdam: Elsevier, p. 271, 1989.
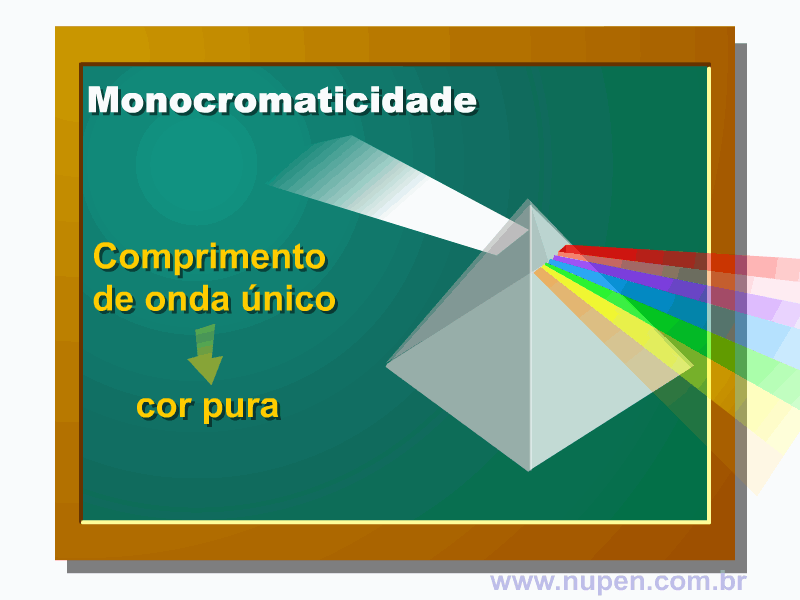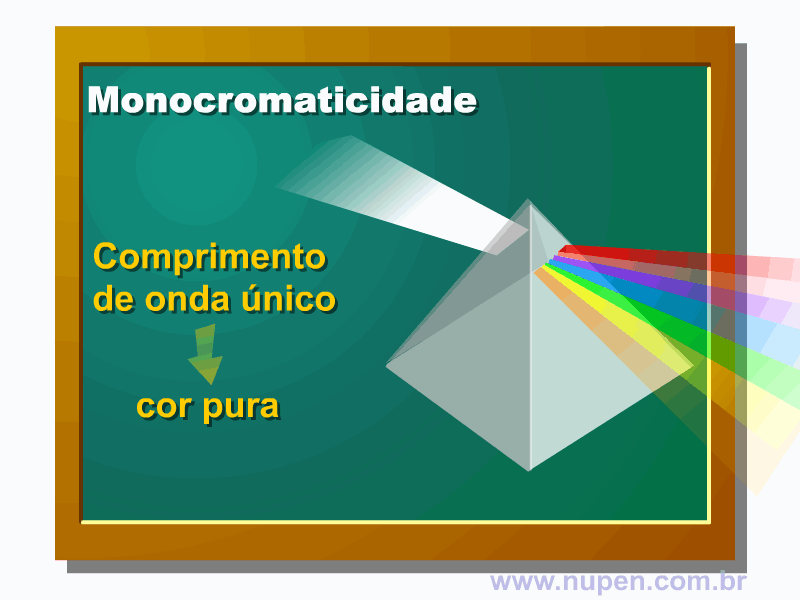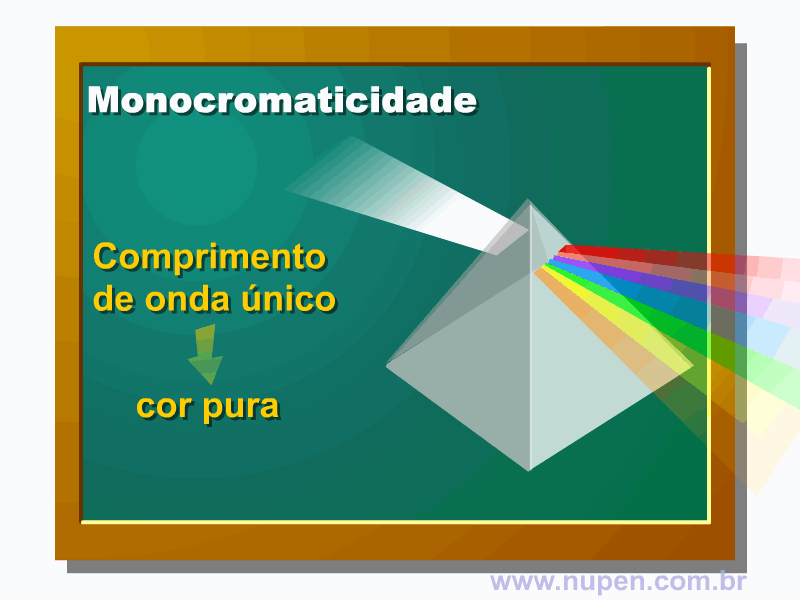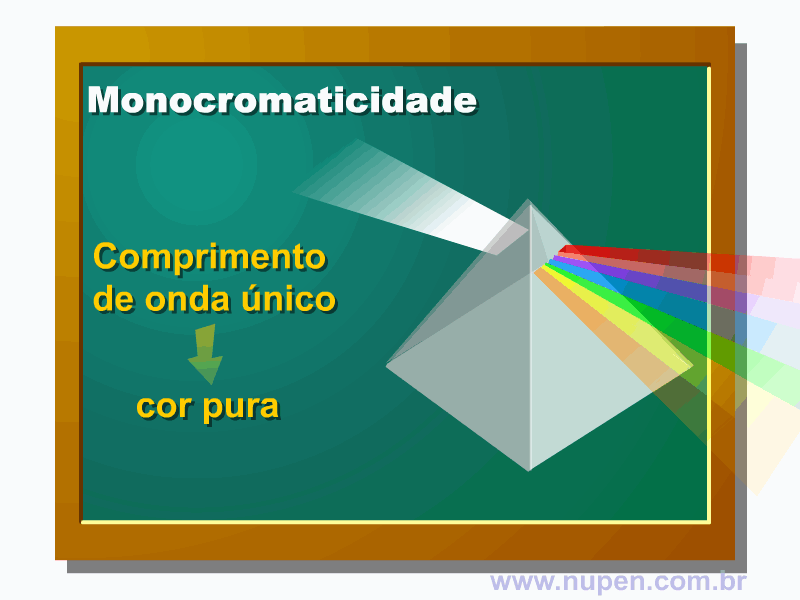
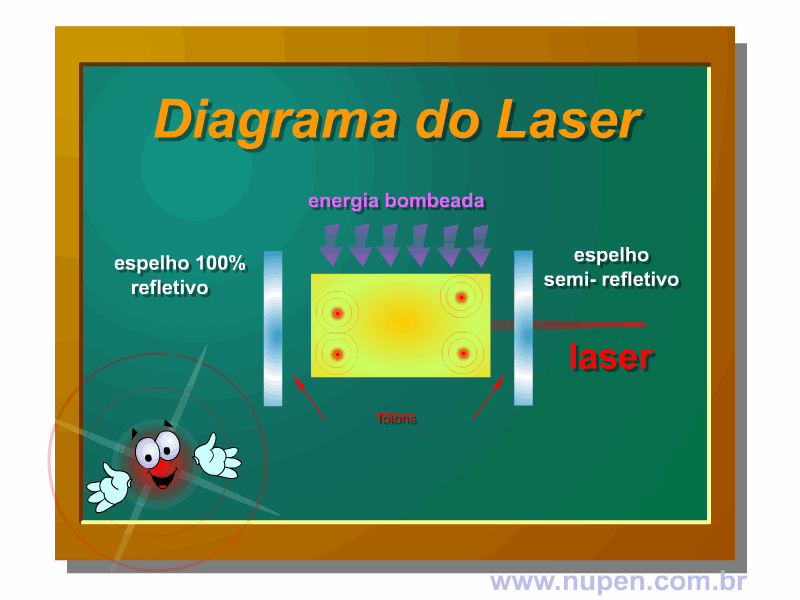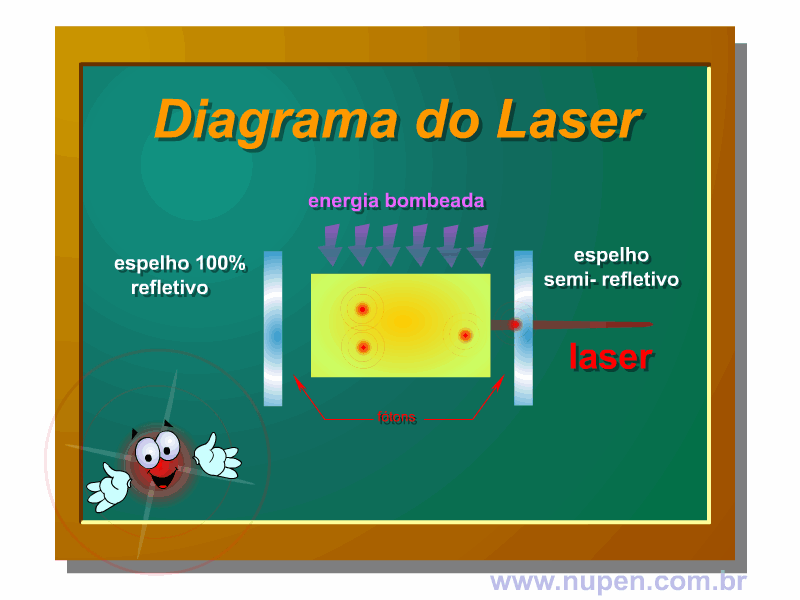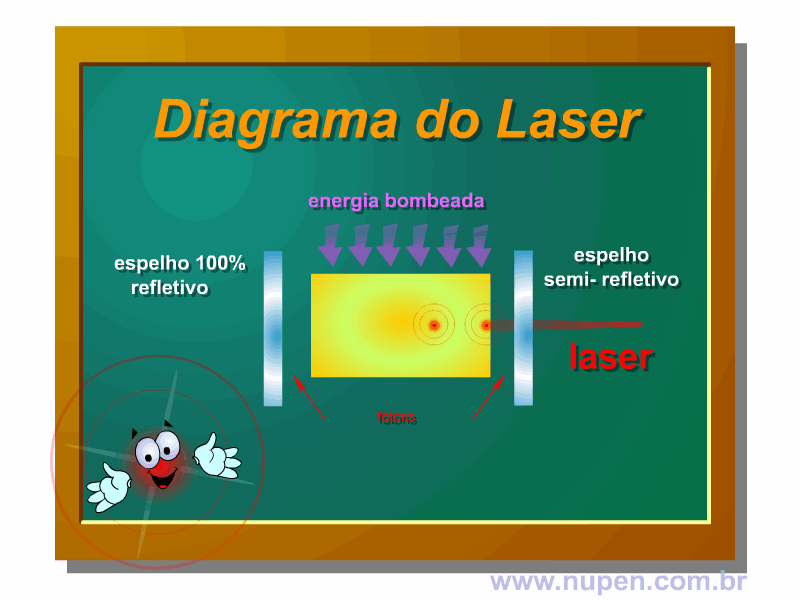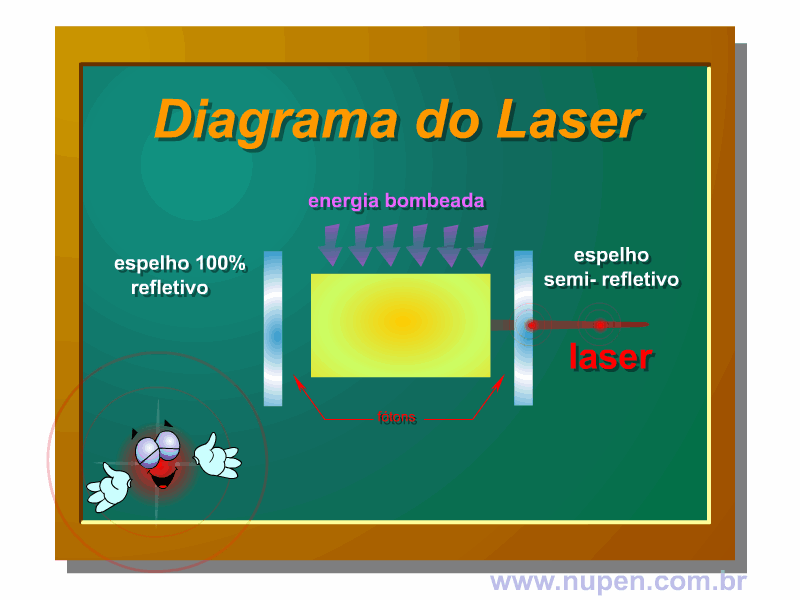
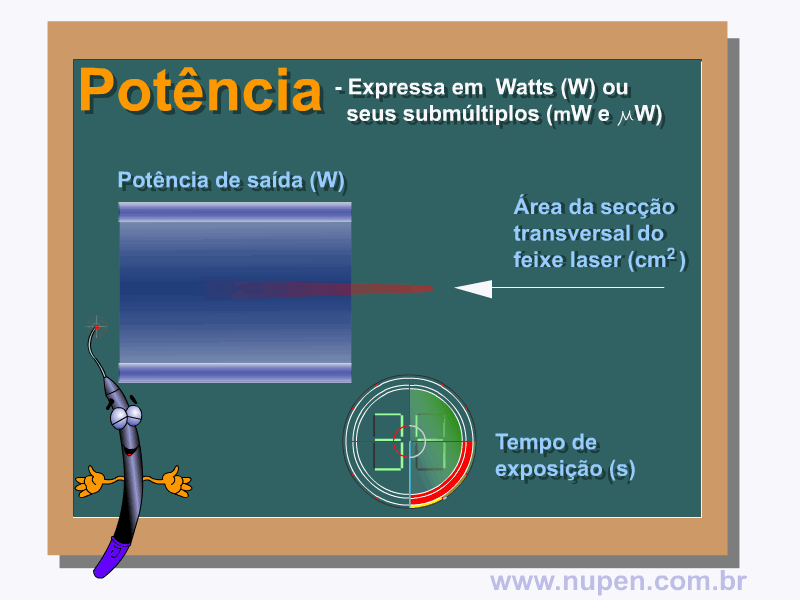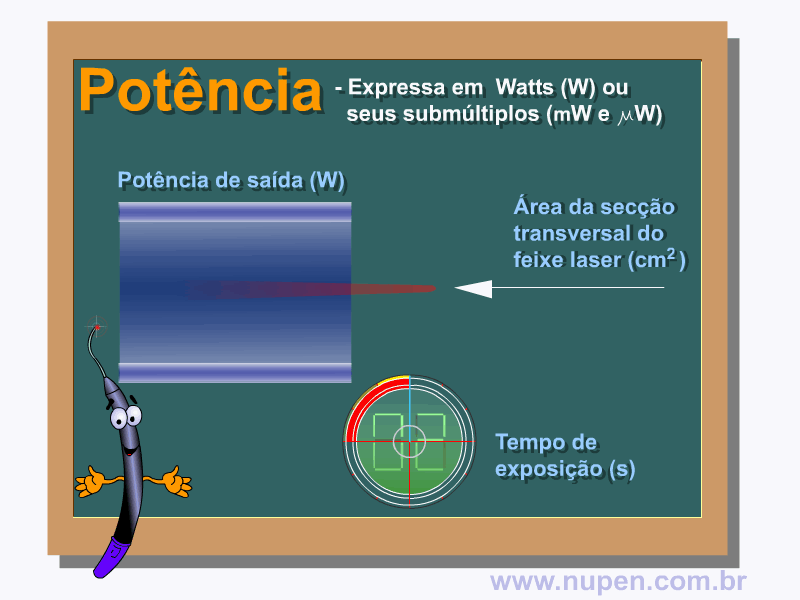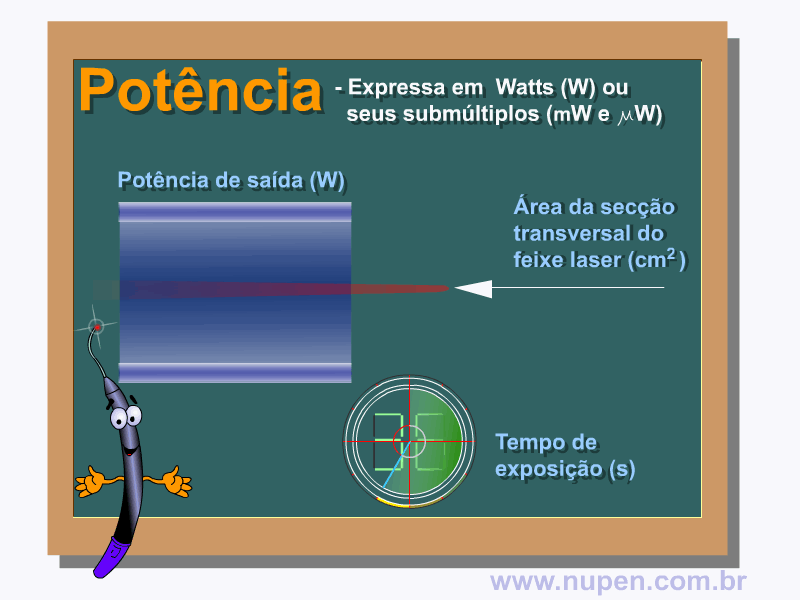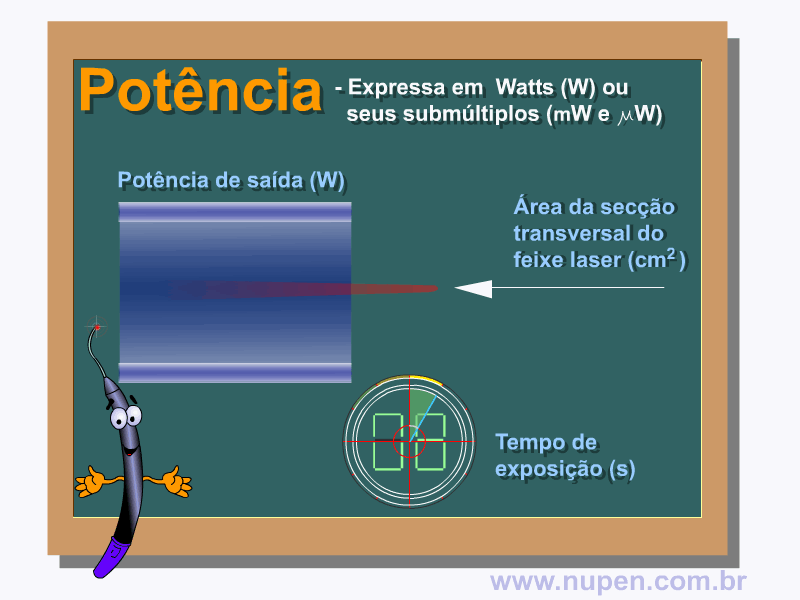
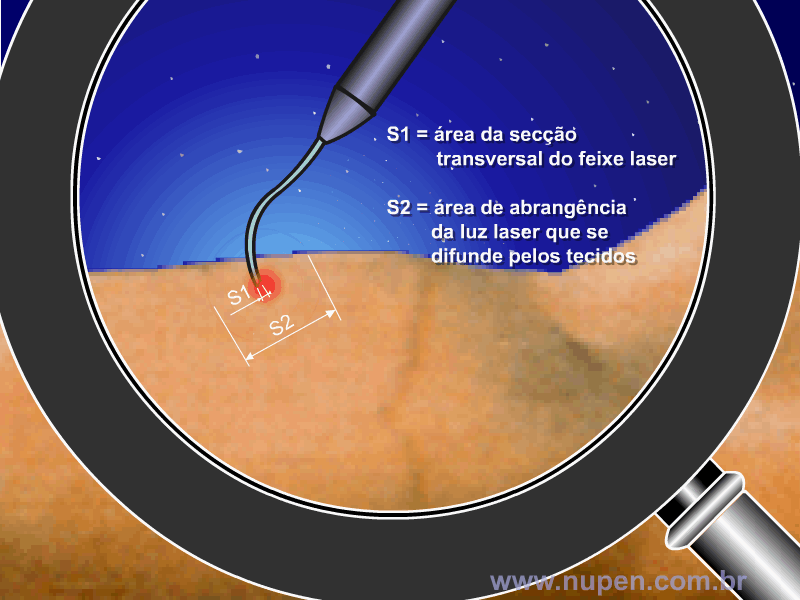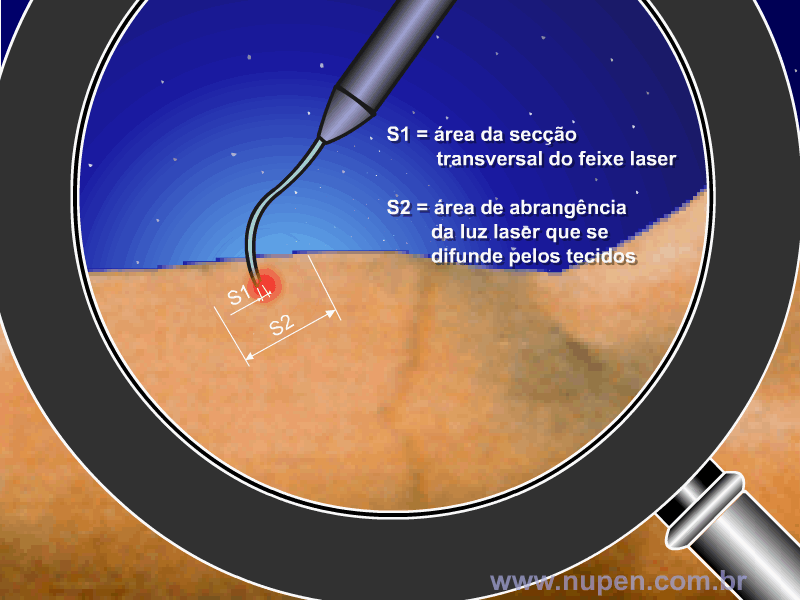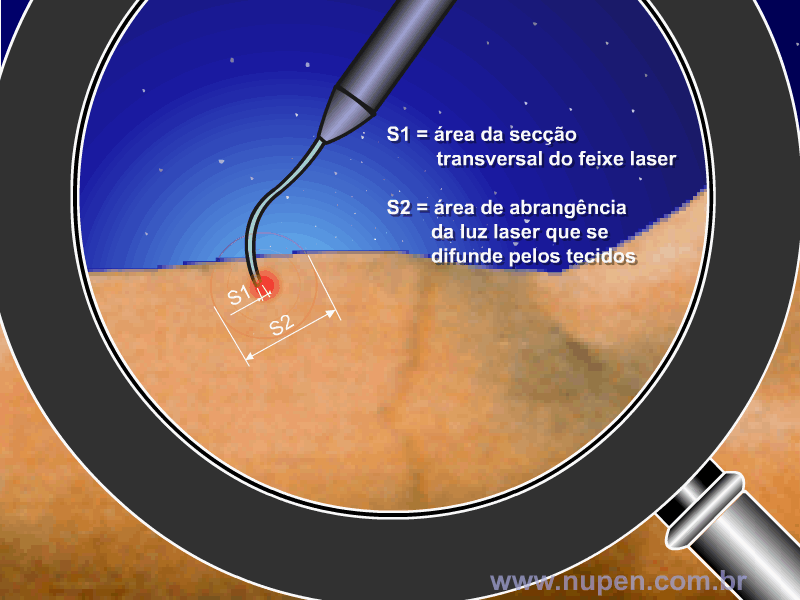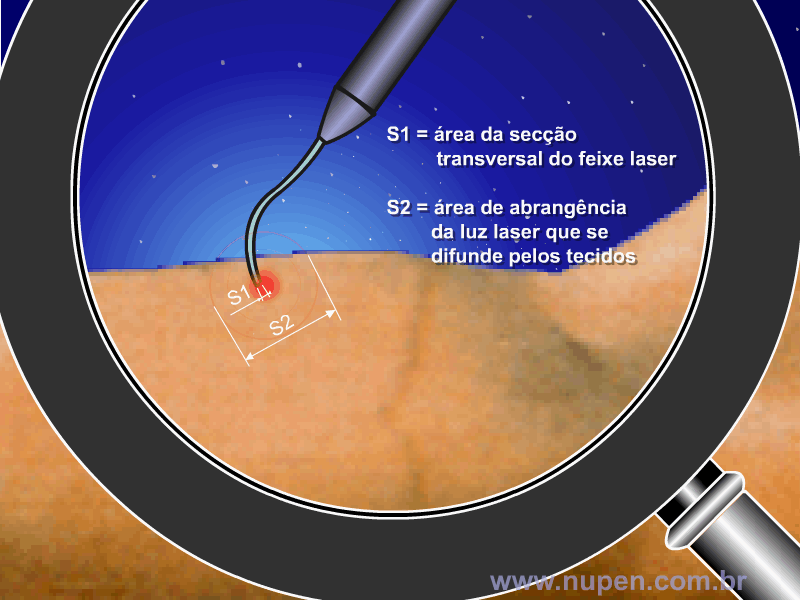
BAGNATO, V. S. Os fundamentos da luz laser. Física na Escola, São Carlos, v.2, n.2, p.4-9, 2001.
BALDRICH, E.; PEREZ, J. L.; PAVESTI, M. CAMARASA, J. M. G.; TRELLES, M. A. Treatment of relapse in Herpes simplex on labial & facial areas and of primary herpes simplex on genital areas and area pudenda with low power laser (He-Ne) or acyclovir administered orally. In: THE INTERNATIONAL SOCIETY FOR OPTICAL ENGINEERING. Proceedings… p.43-48, 1994.
BANIANDRES O, BOIXEDA P, BELMAR P, PEREZ A. Treatment of lupus erythematosus with pulsed dye laser. Lasers Surg Med. 2003;32(4):327-30.
BARABASH AG, Kats AG, Getling ZM. Experience in treating patients with lichen ruber planus by using a helium-neon laser. Stomatologiia (Mosk). 1995;74(1):20-1.
BAXTER, G. D. Therapeutic Lasers, Theory and Practice. Churchill Livingstone, Sinagapore, 1994.
BENSADOUN, R. J.; FRANQUIN, J. C.; CIAIS, G.; DARCOURT, V.; SCHUBERT, M. M.; VIOT, M.; DEJOU, J.; TARDIEU, C.; BENEZERY, K.; NGUYEN, T. D.; LAUDOYER, Y.; DASSONVILLE, O.; POISSONNET, G.; VALLICIONI, J.; THYSS, A.; HAMDI, M.; CHAUVEL, P.; DEMARD, F. Low Energy He-Ne Laser in the Prevention of Radiation-Induced Mucositis. Supp. Care in Cancer: Off. Jour. Multi. Assoc. Support. Care in Canc., v.7, n.4, p.244-52, jul, 1999.
BOLOGNANI, L.; MAJNI, G.; COSTATO, M.; MILANI, M. ATPase and ATPsynthetase activity in myosin exposed to low power laser and pulsed electromagnetic fields. Bioelectrochem Bioenergetics, v.32, p.155-164, 1993.
BOLTON, P.; YOUNG, S.; DYSON, M. The direct effect of 860nm light on cell proliferation and on succinic deshydrogenate activity of human fibroblasts in vitro. Laser Therapy, v.7, p.55-60, 1995.
BRADLEY, P. F. The application of lasers in medicine: future implications for the next millennium., Brunei International Medical Journal, 1:1, p.105-114, 1999.
BRADLEY, P. F.; GROTH, E.; GURSOY, B.; KARASU, H.; RAJAB, A.; SATTAYUT, S. The maxillofacial region: recent research and clinical practice in low intensity laser therapy (LILT). In: SIMUNOVIC, Z. Lasers in Medicine and Dentistry: basic and up-to-date clinical application of Low Energy-Level Laser Therapy: LLLT. Rijeka: Vitagraf, p. 385-402, 2000.
BRADLEY, P. F.; REBLIINI, Z. Low intensity laser therapy (LILT) for temporomandibular joint pain: a clinical electromyographic and thermographic study. Laser Therapy, 8(1), abstract 47, 1996.
CALDERHEAD, R. G. The Nd:YAG and GaAIAs lasers: a laser comparative analysis in pain therapy. In: ATSUMI, K.; NIMSAKUL, N. Laser. Tokyo: Japan Society for Laser Medicine, v.21, n.1, 1981.
CAMBIER D, BLOM K, WITVROUW E, OLLEVIER G, De Muynck M and Vanderstraeten G. The Influence of Low Intensity Infrared Laser Irradiation on Conduction Characteristics of Peripheral Nerve: A Randomised, Controlled, Double Blind Study on the Sural Nerve Lasers Med Sci 2000, 15:195–200.
CATÃO MHCV. Os benefícios do laser de baixa intensidade na clínica odontológica na estomatologia. Revista_port Brasileira de Patologia Oral 2004; 3(4): 214-218.
CATÃO MHCV; COSTA, LJ Treatment of periconits with low power laser. RGO (PORTO ALEGRE);52(3):175-186, jul.-set. 2004.
CETINER S, KAHRAMAN SA, YUCETAS S. Evaluation of low-level laser therapy in the treatment of temporomandibular disorders. Photomed Laser Surg. 2006 Oct;24(5):637-41.
CONVISSAR AR. Laser palliation of oral manifestations of human immunodeficiency virus infection. JADA; 2002, 133:591-598.
CONVISSAR RA, DIAMOND LB, FAZEKAS CD. Laser treatment of orthodontically induced gingival hyperplasia. Gen Dent. 1996 Jan-Feb;44(1):47-51.
CRUCCU G, Pennisi E, Truini A, Iannetti GD, Romaniello A, Le Pera D, De Armas L, Leandri M, Manfredi M, Valeriani M.Unmyelinated trigeminal pathways as assessed by laser stimuli in humans. Brain. 2003 Oct;126(Pt 10):2246-56.
CRUZ DR, KOHARA EK, RIBEIRO MS, Wetter NU. Effects of low-intensity laser therapy on the orthodontic movement velocity of human teeth: a preliminary study. Lasers Surg Med. 2004;35(2):117-20.
DORTBUDAK O, Haas R, Mailath-Pokorny G. Effect of low-power laser irradiation on bony implant sites. Clin Oral Implants Res. 2002 Jun;13(3):288-92.
DVORETSKII DP, TIMOSHENKO TE, BELOBOKOVA NK. Effect of low-intensity He-Ne laser irradiation on rat mesenteric microcirculation. Ross Fiziol Zh Im I M Sechenova. 2004 Nov;90(11):1356-62.
ECKERDAL, A.; LEHMANN, B. H. Can low reactive-level laser therapy be used in the treatment of neurogenic facial pain? A double-blind, placebo controlled investigation of patients with trigeminal neuralgia. Laser Therapy, 8(4):247/52, 1996.
ENWEMEKA, C. S.; RODRIGUEZ, O.; GALL, N.; WALSH, N. Morphometries of collagen fibril populations in He-Ne laser photostimulated tendons. J Clin Laser Med Surg, p. 47-52, Dic. 1990.
FREITAS, I.G.F.; BARANAUSKAS, V.; CRUZ-HOFLING, M.A. Laser effects on osteogenesis. Applied Surface Science 154-155, p. 548-554, 2000.
FRIEDMAN et al. Somatosensory trigeminal evoked potential amplitudes following low level laser irradiation over time. Proc. 7 th Int Congr lasers in Dentistry, ISLD, Brussels, Belgium, abstr. 14, July, 2000.
FRIEDMANN, H.; LUBART, R.; LAULICHT, I. A possible explanation of laser-induced stimulation and damage of cell cultures. J Photochem Photobiol B: Biol, v. 11, p. 87-95, 1991.
GROTH, E. B. Treatment of dentine hypersensitivity with low power laser of Ga-Al-As. J Dent Res 74(3):794, Abstract 163, 1995.
GUANG HUA, W. et al. A study on the analgesic effect of low power HeNe-laser and its mechanism by electrophysiological jeans. In: Lasers in Dentistry. Excerpta Medica. Elsevier Science Publishers, Amsterdam, p.277, 1989.
GUZZARDELLA GA, Torricelli P, Nicoli-Aldini N, Giardino R. Osseointegration of endosseous ceramic implants after postoperative low-power laser stimulation: an in vivo comparative study. Clin. Oral Impl. Res, 14, 2003; 226–232.
GUZZARDELLA, G. A.; FINI, M.; TORRICELLI, P.; GIAVARESI, G.; GIARDINO, R. Laser Stimulation on Bone Defect Healing: An In Vitro Study. Lasers Med Sci, 17:216-220, 2002.
HALEVY, S.; LUBART, R.; REUVENI, H.; GROSSMAN, N. Infrared (780 nm) low level laser therapy for wound healing: in vivo and in vitro studies. Laser Therapy, v.9, p.159-164, 1997.
HASHIMOTO, T.; KEMMOTSU, O.; OTSUKA, H.; NUMAZAWA, R.; OHTA, Y. Efficacy of laser irradiation on the area near the stellate ganglion is dose-dependent: a double-blind crossover placebo-controlled study. Laser Therapy, 9:7-12, 1997.
HAWKINS D, ABRAHAMSE H. Effect of multiple exposures of low-level laser therapy on the cellular responses of wounded human skin fibroblasts. Photomed Laser Surg. 2006 Dec;24(6):705-14.
HERASCU N, VELCIU B, CALIN M, SAVASTRU D, TALIANU C. HERNÁNDEZ, G.S.D.; DIAZ, M.C.R.; CHELALA, J.R.A.; HERNÁNDEZ, R.M.D.; ANDREU, M.I.G.; LLANES, E.L. Tratamiento de defectos óseos horizontals en periodoncia con laser helio-neón. Rev. Cubana Med Mil, 26(2):110-115, 1997.
HONG, J. N.; KIM, T. H.; LIM, S. D; Clinical trial of low reactive-level laser therapy in 20 patients with postherpetic neuralgia. Laser Therapy, 2(4): 167-170, 1990.
HOUAISS, A., VILLAR, M.S. Dicionário da Língua Portuguesa, Editora Objetiva, Rio de Janeiro, 2001.
IIJIMA, K. Evaluation of analgesic effect of low power He:Ne laser on postherpetic neuralgia using VAS and midified McGill pain questionaire. J Clin Laser Med Surg, v.2, n.9, p.121, 1991.
KANDOLF-SEKULOVIC L, KATARANOVSKI M, PAVLOVIC MD Immunomodulatory effects of low-intensity near-infrared laser irradiation on contact hypersensitivity reaction. Photodermatol Photoimmunol Photomed 2003; 19: 203–212.
KARU, T. I. Biological action of low intensity visible monochromatic light and some of as medical applications. In: GALLETI, G. (Ed). Laser. Bologna, Itália, p.381, 1985.
KARU, T. I. Molecular mechanism of the therapeutic effect of low-intensity laser radiation. Lasers Life Sci, v.2, n.1, p.53-74, 1988.
KARU, T. I. Photobiological fundamentals of low power laser therapy. IEEE Journal Quantum Electronics QE-23, v.10, p.1703-1717, 1987.
KARU, T.; RYABYKH, T. P.; FEDOSEYEVA, G. E.; PUCHKAVA, N. I. Helium-Neon laser-induced respiratory burst of phagocyte cells. Lasers Surg Med, v.9, p.585-588, 1989.
KARU, T. I.; SMOLYANINOVA, N. K.; ZELENIN, A. V. Long-term and short-term responses of human lymphocytes to He-Ne laser radiation. Lasers Life Sci, v.4, n.3, p.167, 1991a.
KATS AG.Low-energy laser radiation in the combined treatment of salivary gland inflammation. Stomatologiia (Mosk). 1993 Oct-Dec;72(4):32-6.
KATS AG, MALOMUD ZP, ZAKHAROVA LM, BAKUN TV. Laser therapy of alveolitis. Stomatologiia (Mosk). 1981 Jan-Feb;60(1):37-9.
KERT, J.; ROSE, L. Clinical laser therapy: low level laser therapy. Copenhagen: Scandinavian Medical Laser Technology, p.140-155, 1989.
KHADRA M. The effect of low level laser irradiation on implant-tissue interaction. In vivo and in vitro studies. Swed Dent J Suppl. 2005;(172):1-63.
KHADRA M, RONOLD HJ, LYNGSTADAAS SP, ELLINGSEN JE, HAANAES HR. Low-level laser therapy stimulates bone-implant interaction: an experimental study in rabbits. Clin Oral Implants Res. 2004 Jun;15(3):325-32.
KHULLAR S. M. et al. Enhanced sensory reinnervation of dental target tissues in rats following low level laser (LLL) irradiation. Lasers Med Sci, 14(3):177-184, 1999.
KHULLAR S. M.; BRODIN, P.; BARKVOLL, P. et al. Preliminary study of low-level laser for treatment of long-standing sensory aberrations in the inferior alveolar nerve. J Oral Maxillofac Surg, 54(2):2-7, 1996.
KIMURA Y, WILDER-SMITH P, YONAGA K, MATSUMOTO K: Treatment of dentine hypersensitivity by lasers: a review. J Clin Periodontol 2000; 27: 715–721.
KOHELET, D.; ROCHKIND, S.; ARBEL, E.; OUAKNINE, G.E. Restoration of phrenic nerve activity in a pre-term newborn using laser therapy. Laser Therapy, 10:71-72, 1998.
KREISLER M, AL HAJ H, D’HOEDT B. Clinical efficacy of semiconductor laser application as an adjunct to conventional scaling and root planing. Lasers Surg Med. 2005 Dec;37(5):350-5.
KREISLER MB, Haj HA, NOROOZI N, WILLERSHAUSEN B. Efficacy of low level laser therapy in reducing postoperative pain after endodontic surgery– a randomized double blind clinical study. Int J Oral Maxillofac Surg. 2004 Jan;33(1):38-41.
KOGAWA EM, KATO MT, SANTOS CN, CONTI PCR. Evaluation of the efficacy of low-level laser therapy (lllt) and the microelectric neurostimulation (mens) in the treatment of myogenic temporomandibular disorders: a randomized clinical trial. J Appl Oral Sci 2005; 13(3): 280 – 5.
KUBOTA, J.; OHSHIRO, T. The effects of diode laser low reactive level laser therapy (LLLT) on flap survival in a rat model. Laser Therapy, v.1, n.3, p.127, 1989.
LACOUR J. Low-power laser and recurrent labial herpes. Ann Dermatol Venereol. 2000 Jun-Jul;127(6-7):652-6.
LIMEIRA-JÚNIOR,F. A. Avaliação do reparo ósseo com o uso de osso anorgânico e membrana reabsorvível após irradiação com laser diodo 830 nm. Tese (Mestrado em Estomatologia), Universidade Federal da Bahia, Salvador, 2001.
LIZARELLI, R. F. Z.; MAZZETTO, M. O.; BAGNATO, V. S. Low-intensity laser therapy to treat dentin hypersensitivity – comparative clinical study using different light doses. Proc. SPIE, v.4422, Editor Tatiana I. Solovieva, p.53-64, 2001.
LOEVSCHALL, H.; ARENHOLT-BINDSLEV, D. Effect of low level diode laser irradiation of human oral mucous fibroblast in vitro. Lasers Surg Med, v.14, p.347-354, 1994.
LOPES CO; Rigau J, Zângaro RA. Prevenção da xerostomia e da mucosite oral induzidas por radioterapia com uso do laser de baixa potência. Radiol Bras vol.39 no.2 São Paulo Mar./Apr. 2006.
LOPEZ, V. J. El laser en el tratamiento de las disfunciones de ATM. Revista_port de Actualidad de Odontoestomatologia Española, jun:35, 1886.
LOWE, A. S.; WALKER, M. D.; O’BYRNE, M.; BAXTER, G. D.; HIRST, D. G. Effect of low intensity monochromatic light therapy (890 nm) on a radiation – Impaired, wound – healing model in murine skin. Lasers Surg Med, v.23, p.291-298, 1998.
LUBART, R.; FRIEDMANN, H.; GROSSMANN, N.; ADAMER, M.; SHAINBERG, A. The role of intracellular calcium oscillations in photobiostimulation. Laser Technol, v.6, n.3, p.79-84, 1996.
LUBART, R.; FRIEDMANN, H.; SINYAKOV, M.; SHIMAN, A.; GROSSMAN, N.; ADAMEK, M.; SHAINBERG, A. The effect of He:Ne Laser (633 nm) radiation on intracellular Ca2+ concentration in fibroblasts. Laser Therapy, v.9, p.115-120, 1997.
MACHNIKOWSKI I, SPIECHOWICZ E. Application of therapeutic laser in treatment of the selected chronic illnesses of the oral cavity. Protet Stomatol. 1989 May-Jun;39(3):147-50.
MAEGAWA, Y.; ITOH, T.; HOSOKAWA, T.; YAEGASHI, K.; NISHI, M. Effects of Near-Infrared Low-Level Laser Irradiation on Microcirculation. Lasers Surg Med, 27:427-437, 2000.
MAIER M.; HAINA D.; LANDTHALER, M. Effect of low energy laser on the growth and regeneration of capillaries. Lasers Med Sci, v.5, p.381-386, 1990.
MARSILIO AL, Rodrigues JR, Borges AB. Effect of the clinical application of the GaAlAs laser in the treatment of dentine hypersensitivity. J Clin Laser Med Surg. 2003 Oct;21(5):291-6.
MARKOVIC A, Todorovic Lj. Effectiveness of dexamethasone and low-power laser in minimizing oedema after third molar surgery: a clinical trial. Int J Oral Maxillofac Surg. 2007 Mar;36(3):2269. Epub 2006 Dec 8.
MARKOVIC AB, Todorovic L. Postoperative analgesia after lower third molar surgery: contribution of the use of long-acting local anesthetics, low-power laser, and diclofenac.
MAVROGIANNIS M, THOMASON JM, SEYMOUR RA. Lasers in periodontology. Dent Update. 2004 Nov;31(9):535-8, 541-2, 545-7.
McKIBBIN, L. et al. Treatment of post herpetic neuralgia using a 904 nm (infrared) loe energy laser: A clinical study. Laser Therapy, 3(1): 35-40, 1991.
MENDEZ TM, PINHEIRO AL, PACHECO MT, NASCIMENTO PM, RAMALHO LM. Dose and wavelength of laser light have influence on the repair of cutaneous wounds. J Clin Laser Med Surg. 2004 Feb;22(1):19-25.
MESTER, E. A laser sugar alkamazaea a gyogyaezatban. Orv Hetilap, v.107, p.1012, 1966.
MESTER, E. Experimentation on the interaction between infrared laser and wound healing. Exper Cirurg, v.2, p.94, 1969.
MEZAWA, S. et al. The possible analgesic effect of soft-laser irradiation on heat nociceptors in the cat tongue. Ach Oral Biol, 33(9), 693, 1988.
MICHALANY, J. Anatomia Patológica Geral na Prática Médico-Cirúrgica. Artes Médicas Ltda, Brasil, 1995.
MIDAMBA, E.D.; HAANAES, H. Effect of low level laser therapy (laser therapy) on inferior alveolar, mental and lingual nerves after traumatic injury in 15 patients. A pilot study. Laser Therapy, 5(2):89-94, 1993.
MIKHAILOVA RI, TEREKHOVA NV, ZEMSKAIA EA, MELKADZE N. The laser therapy and laser acupunture of patients with chronic recurrent aphthous stomatitis. Stomatologiia(Mosk).1992,May-Dec;(3-6):27-8.Russian.
MILORO M, Miller JJ, Stoner JA. Low-level laser effect on mandibular distraction osteogenesis.
MOORE, K. et al. LLLT treatment of post herpetic neuralgia. Laser Therapy, pilot issue, 1:7, 1988.
MORRONE, G.; GUZZARDELLA, G. A.; ORIENTI, L.; GIAVARESI, G.; FINI, M.; ROCCA, M.; TORRICELLI, P.; MARTINI, L. GIARDINO, R. Muscular trauma treated with a Ga-Al-As diode laser: In Vivo experimental study. Lasers Med Sci, v.13, p.293-298, 1998.
NAVARRO, R; MARQUEZAN, M; CERQUEIRA, D; SILVEIRA, BL; CORRÊA, MSNP. Low-level-laser therapy as an alternative treatment for primary herpes simplex infection: a case report. J Clin Ped Dent 31(4) August, 2007 (in press).
NOYA MS, BEZERRA RB, LOPES JL, PINHEIRO ALB. Clinical evaluation of the immediate effectiveness of gaaias laser on the therapy of dentin hypersensitivity. J Appl Oral Sci 2004; 12(4): 363-6.
NUNEZ SC, GARCEZ AS, SUZUKi SS, RIBEIRO MS. Management of mouth opening in patients with temporomandibular disorders through low-level laser therapy and transcutaneous electrical neural stimulation. Photomed Laser Surg. 2006 Feb;24(1):45-9.
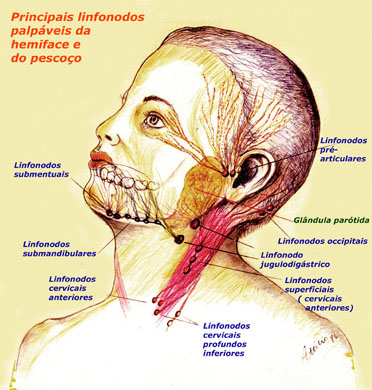
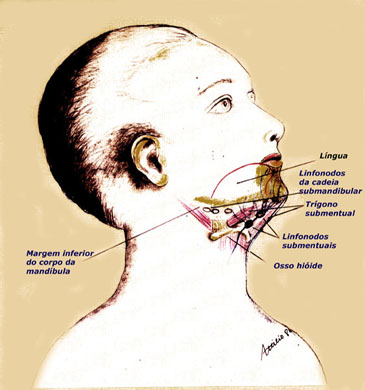
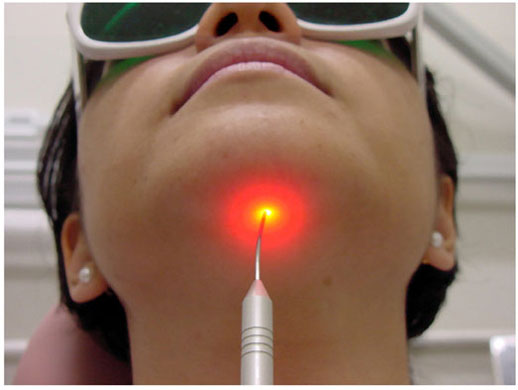
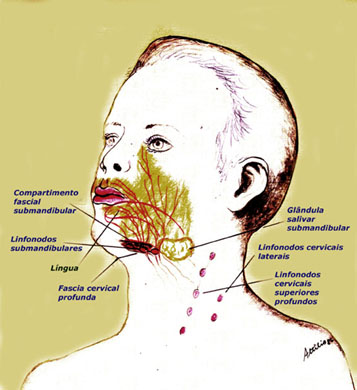
OASEVICH, I. A. Infrakrasnoe nizkointensivnoe lazernoe izluchenie v diagnostike I kompleksnom lechenii ostrogo nespetsificheskogo limfadenita litsa I shei u detei. [Low-intensity infrared laser radiation in the diagnosis and combined treatment of acute non-specific lymphadenitis of the face and neck in children]. Stomatologiia (Mosk), 78(2):28-31, 1999.
OHSHIRO, T.; CALDERHEAD, R. G. The development of low reactive-level laser therapy (LLLT) and its present status. J Clin Laser Med and Surg, v. 9, n.4, p. 267-275, 1991.
OMURA, Y.; LOSCO, B. M.; OMURA, A. K. et al. Common factors contributing to intractable pain and medical problems with sufficient drug uptake in areas to be treated, and their pathologies and treatment. Acupunct Electrother Res, 17(2):107, 1992.
OSTUNI, A.; PASSARELLA, S.; QUAGLIANIELLO, E. The energy dose dependence of the activity of glutamate de hydrogenase irradiated with helium neon laser. Laser Technol, v.4, n.1/2, p.13-16, 1994.
OZEN T, ORHAN K, GORUR I, OZTURK A. Efficacy of low level laser therapy on neurosensory recovery after injury to the inferior alveolar nerve. Head Face Med. 2006 Feb 15; 2:3.
PALMGREN, N. Low-power laser therapy in rheumatoid arthritis. Lasers Med Sci, v. 12, p. 441, 1992.
PAOLINI, L. E.; PAOLINI, D. tratamiento de la parálisis de Bell con láser de baja potencia. Estúdio prospectivo. Proc II Congr Internat Assn for Laser and Sports Medicine, Rosario, Argentina, march, 2000.
PASSARELLA, S.; CASAMASSIMA, E.; MOLINARI, S.; PASTORE, D.; QUAGLIARIELLO, E.; CATALANO, I. M.; CINGOLANI, A. Increase of proton electrochemical and ATP synthesis in rat liver mitochondria irradiated in vitro by Helium-Neon láser. Febs Letters , v.175, n. 1, p. 95, 1984.
PINHEIRO AL, CAVALCANTI ET, PINHEIRO TI, ALVES MJ, MANZI CT. Low-level laser therapy in the management of disorders of the maxillofacial region. J Clin Laser Med Surg. 1997; 15(4):181-3.
PINHEIRO AL, CAVALCANTI ET, PINHEIRO TI, ALVES MJ, MIRANDA ER, De QUEVEDO AS, MANZI CT, VIEIRA AL, ROLIM AB. Low-level laser therapy is an important tool to treat disorders of the maxillofacial region. J Clin Laser Med Surg. 1998 Aug;16(4):223-6.
PLAVNIK LM, De CROSA ME, MALBERTI AI. Effect of low-power radiation (helium/neon) upon submandibulary glands. J Clin Laser Med Surg. 2003 Aug;21(4):219-25.
POURREAU-SCHNEIDER, N.; SOUDRY, M.; REMUSAT, M.; FRANQUIN, J. C.; MARTIN, P. M. Modifications of growth dynamics and ultrastructure after helium-neon laser treatment of human gingival fibroblast. Quintessence Int, v.20, n. 12, p.887-893, Sep. 1989.
PRIKULS VF. Experience in irradiating with helium-neon lasers to treat patients with relapsing aphthous stomatitis Stomatologiia. 2000;79(6):20-2.
QADRI T, MIRANDA L, TUNER J, GUSTAFSSON A. The short-term effects of low-level lasers as adjunct therapy in the treatment of periodontal inflammation. J Clin Periodontol. 2005 Jul;32(7):714-9.
RALLIS TR.Low-intensity laser therapy for recurrent herpes labialis. J Invest Dermatol. 2000 Jul;115(1):131-2.
ROCHKIND, S. Central nervous System transplantation benefited by Low-power Laser Irradiation. Lasers in Medical Science, 7:143-151, 1992b.
ROCHKIND, S. Laser therapy in the treatment of peripheral nerves, brachial plexus and spinal cord injuries. Proceedings of the International Laser Congress, Athens, Greece, 25-28, September, 1996.
ROCHKIND, S.; OUAKNINE, G. E. New trend in neuroscience: low-power laser effect on peripheral and central nervous system (basic science, preclinical and clinical studies). Neurological Research, 14:02-11, march, 1992a.
ROCHKIND, S.; ROUSSO, M.; NISSAN, M.; VILLAREAL, M.; BARR-NEA, L.; REES, D. G. Systemic effects of Low-Power Laser irradiation on the peripheral and central nervous system, cutaneous wounds, and burns. Lasers Surg Med, v.9, p.174-182, 1989.
RODRIGUES R. C.; ELGELMANN, E.; BRUGNERA, A.; ALMEIDA-LOPES, L.; DUARTE, D.A.. Clinical study of the lasertherapy antinflamatory action on the tissues reparation after iatrogenics trauma. In: ANNUAL MEETING- LASERS IN SURGERY AND MEDICINE, Proceedings…Florida, EUA, p.13, 1999.
SAKURAI Y, YAMAGUCHI M, ABIKO Y.INHIBITORY effect of low-level laser irradiation on LPS-stimulated prostaglandin E2 production and cyclooxygenase-2 in human gingival fibroblasts.
SASAKI, K.; OHSHIRO, T. Role of Low Reactive-Level Laser Therapy (LLLT) in the treatment of acquired and cicatrical vitiligo. Laser Therapy, v.1, n.3, p.141-144, 1989.
SCHAFFER, M.; BONEL, H.; SROKA, R.; SCHAFFER, P. M.; BUSCH, M.; REISER, M.; DÜHmke, e. Effects of 780 nm diode laser irradiation on blood microcirculation: preliminary findings on time-dependent T1-weighted contrast-enhanced magnetic resonance imaging (MRI). J Photoch Photobio B, v. 54, n. 1, p.55-60, jan, 2000.
SCHINDL A, NEUMANN R.Low-intensity laser therapy is an effective treatment for recurrent herpes simplex infection. Results from a randomized double-blind placebo-controlled study. J Invest Dermatol. 1999 Aug;113(2):221-3.
SCHINDL A, SCHINDL M, SCHIND L.Phototherapy with low intensity laser irradiation for a chronic radiation ulcer in a patient with lupus erythematosus and diabetes mellitus. Br J Dermatol. 1997 Nov;137(5):840-1.
SILVA-JÚNIOR, A. N. avaliação do efeito do laser diodo (GaAlAs) infravermelho de 830 nm na biomodulação da cicatrização óssea. Dissertação (Programa de Pós-Graduação em Cirurgia e Traumatologia Buço-maxilo-facial). Pontifícia Universidade Católica do Rio Grande do Sul, 2000.
SILVA JUNIOR AN, PINHEIRO AL, OLIVEIRA MG, WEISMANN R, RAMALHO LM, NICOLAU RA. Computerized morphometric assessment of the effect of low-level laser therapy on bone repair: an experimental animal study. J Clin Laser Med Surg. 2002 Apr;20(2):837.
SKINNER, S. M.; GAGE, J. P.; WILCE, P.A.; SHAW, R. M. A preliminary study of the effects of laser radiation on collagen metabolism in cell culture. Aust Dent J, v.41, p.3, 1996.
SKOBELKIN, O. K.; MICHAILOV, V. A.; ZAKHAROVT, S. D. Preoperative activation of the immune system by low reactive level laser therapy (LLLT) in oncologic patients: A preliminary report. LLLT Cancer Surg, p.169-175, 1991.
STAINKI DR, RAISER AG; GRAÇA DL; BECKER C; FERNANDEZ GMS. A radiação laser arseneto de gálio (AsGa) na regeneração do nervo radial submetido a reparação cirúrgica secundária. Braz. J. vet. Res. anim. Sci., 1998, 35(1):37-40.
STEINLECHNER, C. W. B; DYSON, M. The effects of low level laser therapy on the proliferation of keratinocytes. Laser Therapy, v.5, p.65-73, 1993.
STERGIOULAS A. – Low-level laser treatment can reduce edema in second degree ankle sprains. Low-level laser treatment can reduce edema in second degree ankle sprains.
STOCKERT K, SCHNEIDER B, PORENTA G, RATH R, NISSEL H, EICHLER I. Laser acupuncture and probiotics in school age children with asthma: a randomized, placebo-controlled pilot study of therapy guided by principles of Traditional Chinese Medicine Pedriatr Allergy Immunol 2007: 18: 160–166.
STRONG, L. H.; BERTHIAUME, F.; YARMUSH, M. L. Control of fibroblast populated collagen lattice contraction by antibody oncontextmenu=”return false” onselectstart=”return false” onmousedown=”return false” targeted photolysis of fibroblasts. Lasers Surg Med, v.21, p.235-247, 1997.
TAKEYOSHI, S.; TAKIYAMA, R.; TSUNO, S.; SAEKI, N.; HIDAKA, S.; MAEKAWA, T. Low reactive-level infrared diode laser irradiation of the area over the stellate ganglion, and stellate ganglion block in treatment of allergic rhinitis: a preliminary comparative study. Laser Therapy 8:159-164, 1996.
TAMACHI, Y. Enhancement of antitumor chemotherapy effect by low level laser irradiation. Tokyo Medical College Newsletter, 888-893, 1991.
TATEY, YOSHIBA K, YOSHIBA N, IWAKU M, OKIJI T, OHSHIMA H. Odontoblast responses to GaAIAs laser irradiation in rat molars: an experimental study using heat-shock protein-25 immunohistochemistry. Eur J Oral Sci 2006; 114: 50–57.
TOSCANI A, BOMBELLI G. Laser therapy in post-extraction alveolitis. Dent Cadmos. 1987 May 31; 55(9):73-4, 77-8.
TRELLES, M. A. Herpes genital y láser de baja potencia. Inv Clin Laser II, v.3, p.120, 1986.
TUNÉR, J.; HODE, L. Laser Therapy – Clinical Practice and Scientific background. Prima Books AB, Tallinn, Estônia, 2002.
TURHANI D, SCHERIAU M, KAPRAL D, BENESCH T, JONKE E, BANTLEON HP.Pain relief by single low-level laser irradiation in orthodontic patients undergoing fixed appliance therapy. Am J Orthod Dentofacial Orthop. 2006 Sep;130(3):371-7.
VALIENTE-ZALDIVAR, C. et al. Laserterapía en la neuralgia trigeminal. Informa preliminar. Rev. Cubana de Estomatología, 2(22), p. 166/171, 1990.
VELÉZ-GONZÁLEZ, M. et al. Activation of the subcutanus absortion of drugs previous laser irradiation. Proc. Ninth Congress of the International Society for Laser Surgery and Medicine, Anaheim, California, USA:2-6, November, 1991.
WALSH LJ. The current status of low level laser therapy in dentistry. Part 2. Hard tissue applications. Aust Dent J. 1997 Oct;42(5):302-6.
WEBB, C.; DYSON, M.; LEWIS, W. H. P. Stimulatory effect on 660 nm low level laser energy on hypertrophic scan-derived fibroblasts: Possible mechanisms for increase in cell culture. Lasers Surg Med, v.22, p.294-301, 1998.
WILDEN, L. The effect of low level laser light on inner ear diseases. In: SIMUNOVIC, Z. Lasers in Medicine and Dentistry: basic and up-to-date clinical application of Low Energy-Level Laser Therapy: LLLT. Rijeka: Vitagraf, p.403-409, 2000.
YAMADA, H.; YAMANAKA, Y.; ORIHARA, H. et al. Preliminary clinical study comparing the effect of low level laser therapy (laser therapy) and corticosteroid therapy in the treatment of facial palsy. Laser Therapy, 7(4):157-162, 1995.
YAMAMOTO, M.; TAMURA, K.; HIRATSUKA, K.; ABIKO, Y. Stimulation of MCM3 Gene Expression in Osteoblast by Low Level Laser irradiation. Lasers Med Sci, 16:213-217, 2001.
YOUSSEF M, Ashkar S, HAMADE E, Gutknecht N, Lampert F, Mir M. The effect of low-level laser therapy during orthodontic movement: a preliminary study. Lasers Med Sci. 2007 Mar 15.
ZIMMERMANN M. Studies on the therapeutic efficacy of a HeNe laser. Dtsch Z Mund Kiefer Gesichtschir. 1990 Jul-Aug;14(4):313-9.
Abramoff MMF, Lopes NNF, Lopes LA, Dib LL, Guilherme A, Caran EM, et al. Low-level laser therapy in the prevention and treatment of chemotherapy-induced oral mucositis in young patients. Photomed Laser Surg. 2008 Aug 26(4):393-400.
Abramoff MMF, Pereira MD, de Seixas Alves MT, Segreto RA, Guilherme A, Ferreira LM. Low-level laser therapy on bone repair of rat tibiae exposed to ionizing radiation. Photomed Laser Surg. 2014 Nov;32(11):618-26. doi: 10.1089/pho.2013.3692.
Bjordal JM, Bensadoun RJ, Tunèr J, Frigo L, Gjerde K, Lopes-Martins RA. A systematic review with meta-analysis of the effect of low-level laser therapy (LLLT) in cancer therapy-induced oral mucositis. Support Care Cancer, 2011 Aug 19(8):1069-77.
Elting LS, Cooksley CD, Chambers MS, Garden AS. Risk, outcomes, and costs of radiation-induced oral mucositis among patients with head-and-neck malignancies. Int J Radiat Oncol Biol Phys. 2007 Jul 15;68(4):1110-20.
Epstein JB, Robertson M, Emerton S, Phillips N, Stevenson-Moore P. Quality of life and oral function in patients treated with radiation therapy for head and neck cancer. Head Neck. 2001 May 23(5):389-98.
Karu, T. Primary and secondary mechanisms of action of visible to near-IR radiation on cells. J. Photochem. Photobiol. B. 1999 Mar 49(1):1-17.
Karu TI, Pyatibrat LV, Afanasyeva NI. A novel mitochondrial signaling pathway activated by visible-to-near infrared radiation. Photochem Photobiol. 2004 Sep-Oct 80(2):366-72.
Loncˇar B, Stipetic ́ MM, Baricˇevic ́ M, Risovic ́D. The Effect of Low-Level Laser Therapy on Salivary Glands in Patients With Xerostomia. Photomedicine and Laser Surgery 2010 Vol (00): 1-5.
Lopes CO, I Mas JR; Zângaro RA. Prevenção da xerostomia e da mucosite oral induzidas por radioterapia com uso do laser de baixa potência. Radiol Bras 2006 vol.39 no.2 São Paulo Mar./Apr.
Oskam IM1, Verdonck-de Leeuw IM, Aaronson NK, Witte BI, de Bree R, Doornaert P et al. Prospective evaluation of health-related quality of life in long-term oral and oropharyngeal cancer survivors and the perceived need for supportive care. Oral Oncol. 2013 May 49(5):443-8. Epub 2013 Jan 11.
Ribeiro GH1, Minamisako MC2, Rath IBDS1, Santos AMB1, Simões A3, Pereira KCR4, Grando LJ1 Osteoradionecrosis of the jaws: case series treated with adjuvant low-level laser therapy and antimicrobial photodynamic therapy. J Appl Oral Sci. 2018;26:e20170172. doi: 10.1590/1678-7757-2017-0172. Epub 2018 May 21.
Sonis, ST. The pathobiology of mucositis. Nat Rev Cancer. 2004 Apr 4(4):277-84.